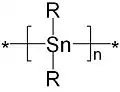
Compuesto de organoestaño
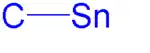
Los compuestos orgánicos de estaño, compuestos de organoestaño, compuestos organoestánnicos o estannanos son compuestos químicos a base de estaño con sustituyentes hidrocarbonados, por tanto, con enlaces químicos entre átomos de carbono y estaño. La química de los organoestánnicos forma parte del amplio campo de la química organometálica.[1][2] El primer compuesto de organoestaño descubierto fue el diyoduro de dietilestaño, estudiado por Edward Frankland en 1849. Un compuesto de estaño se aplica comercialmente como limpiador (scavenger) de residuos de ácido clorhídrico (o estabilizador térmico) en cloruro de polivinilo y también como biocida. El óxido de tributilestaño ha sido ampliamente utilizado como conservante de la madera. Los compuestos de tributilestaño se utilizan como agentes contra las bioincrustaciones (biofouling) marinas. Las preocupaciones sobre la toxicidad [2] de estos compuestos (algunos informes describen efectos biológicos sobre la vida marina en una concentración de 1 nanogramo por litro), han llevado a su prohibición en todo el mundo por la Organización Marítima Internacional. El tricloruro de n-butilestaño se utiliza en la producción de capas de dióxido de estaño sobre botellas de vidrio por deposición de vapor químico.
Estructura
Los compuestos organoestánnicos se clasifican generalmente según sus estados de oxidación. Los compuestos de estaño(IV) son mucho más comunes y útiles.
Derivados orgánicos de estaño (IV)
Los derivados de organoestaño (IV) son siempre tetraédricos. Compuestos del tipo SnRR'R''R''' presentan quiralidad, por lo que tienen pares de enantiómeros.[3]
Haluros de organoestaño
Los cloruros de organoestaño tienen la fórmula R
4-nSnCl
n para valores de n hasta 3. También se conocen bromuros, yoduros y fluoruros, pero son menos importantes. Estos compuestos se conocen para muchos grupos R. Siempre son tetraédricos. Los trihaluros y dihaluros forman aductos con buenas bases de Lewis, como la piridina. Los fluoruros tienden a asociarse de tal manera que el difluoruro de dimetilestaño forma polímeros laminares. Los haluros de di- y, especialmente, de tri-organoestaño, como el cloruro de tributilestaño, presentan toxicidades similares a las del cianuro de hidrógeno.[4]
Hidruros de organoestaño
Los hidruros de organoestaño tienen la fórmula R
4-nSnH
n para valores de n hasta 3. El miembro padre de esta serie, el estannano (SnH
4), Es un gas incoloro inestable. Su estabilidad se correlaciona con el número de sustituyentes orgánicos. El hidruro de tributilestaño se utiliza como fuente de radicales hidruro en algunas reacciones orgánicas.
Óxidos e hidróxidos de organoestaño
Los óxidos e hidróxidos de organoestaño son productos comunes de la hidrólisis de haluros de organoestaño. A diferencia de los derivados correspondientes de silicio y germanio, los óxidos e hidróxidos de estaño a menudo adoptan estructuras con centros de estaño penta- e incluso hexacoordinados, especialmente para los derivados diorgano- y monoorganoestannano. El grupo SnIV
−O−SnIV
se denomina estannoxano (que es un análogo de estaño de los éteres), y el grupo SnIV
−O−H también se denomina estannanol (que es un análogo de estaño de los alcoholes).[5] Los óxidos e hidróxidos estructuralmente más simples son los derivados de triorganoestaño. Un hidróxido de triorganoestaño de importancia comercial es el acaricida cihexatina (también llamado Plictran, hidróxido de triciclohexilestaño y triciclohexilestaño), (C
6H
11)
3SnOH. Estos hidróxidos de triorganoestaño existen en equilibrio con los distannoxanos:
- 2 R
3SnOH ⇌ R
3SnOSnR
3 + H
2O
Con solo dos sustituyentes orgánicos en cada centro de Sn, los óxidos e hidróxidos de diorganoestaño son estructuralmente más complejos que los derivados triorgano.[6] Los dioles geminales de estaño simples (R
2Sn(OH)
2, los análogos de estaño de los dioles geminales R
2C(OH)
2) y las estannanonas monoméricas (R
2Sn=O, los análogos de estaño de las cetonas R
2C=O) son desconocidos. Los óxidos de diorganoestaño (R
2SnO) son polímeros excepto cuando los sustituyentes orgánicos son muy voluminosos, en cuyo caso son trímeros cíclicos o, en el caso en que R es dímeros CH(Si(CH
3)
3)
2, con anillos Sn
3O
3 y Sn
2O
2. Los distannoxanos existen como dímeros con la fórmula [R
2SnX]
2O
2, donde los grupos X (p. ej., cloruro –Cl, hidróxido –OH, carboxilato RCO
2−) pueden ser terminales o puente (véase la tabla). La hidrólisis de los trihaluros de monoorganoestaño tiene el potencial de generar ácidos estannónicos, RSnO
2H. En cuanto a los óxidos/hidróxidos de diorganoestaño, las especies de monoorganoestaño forman estructuras complejas debido a la deshidratación/hidratación y agregación. Un ejemplo ilustrativo es la hidrólisis del tricloruro de butilestaño para obtener [(CH
3(CH
2)
3Sn)
12O
14(OH)
6]2+.
-
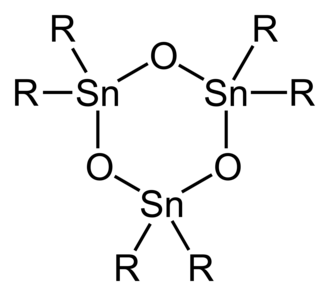 Estructura idealizada del óxido de diorganoestaño trimérico.
Estructura idealizada del óxido de diorganoestaño trimérico. -
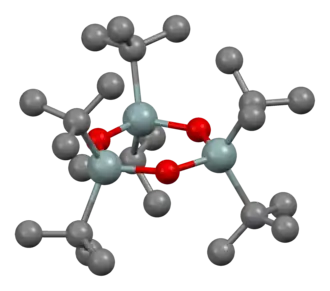 Modelo de bolas y palos de (((CH
Modelo de bolas y palos de (((CH
3)
3C)
2SnO)
3. -
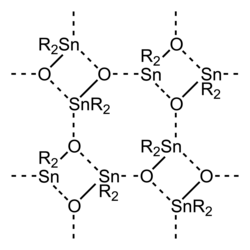 Estructura del óxido de diorganoestaño, destacando la extensa unión intermolecular.
Estructura del óxido de diorganoestaño, destacando la extensa unión intermolecular.
Cationes de triorganoestaño
Some reactions of triorganotin halides implicate a role for R3Sn+ intermediates. Such cations are analogous to carbocations. They have been characterized crystallographically when the organic substituents are large, such as 2,4,6-triisopropylphenyl.[7]
Radicales de estaño (derivados orgánicos del estaño(III))
Los radicales de estaño, con la fórmula R
3Sn, se denominan radicales estannilo.[8] Son un tipo de radical tetrel y se utilizan como intermediarios en ciertas reacciones de transferencia atómica. Por ejemplo, el hidruro de tributilestaño (tris(n-butil)estannano) sirve como una fuente útil de "átomos de hidrógeno" debido a la estabilidad del radical tributilestaño.[9]
Derivados orgánicos de estaño(II)
Los compuestos organoestánnicos (II) son relativamente raros. Los compuestos con la fórmula empírica SnR
2 son algo frágiles y existen como anillos o polímeros cuando R no es voluminoso. Los polímeros, llamados poliestannanos, tienen la fórmula (SnR
2)
n.
En principio, se podría esperar que los compuestos de estaño (II) formen análogos de estaño de alquenos con un doble enlace formal entre dos átomos de estaño (R
2Sn=SnR
2) o entre un átomo de estaño y un átomo de un grupo de carbono (p. ej., R
2Sn=CR
2 y R
2Sn=SiR
2). De hecho, los compuestos con la fórmula R
2Sn=SnR
2, llamados distannilenos o distanilenos, que son análogos de estaño de etilenos R
2C=CR
2, son conocidos por ciertos sustituyentes orgánicos. Los centros Sn en los estannenos son trigonales. Pero, a diferencia de los centros C en los alquenos que son trigonales planares, los centros Sn en los estannenos tienden a ser altamente piramidales. Los compuestos monoméricos con la fórmula SnR2, análogos de estaño de carbenos CR2 también se conocen en algunos casos. Un ejemplo es Sn(SiR3)2, donde R es el muy voluminoso CH(Si(CH
3)
3)
2. Estas especies se dimerizan reversiblemente al distanileno tras la cristalización:[12]
- 2 R
2Sn ⇌ R
2Sn=SnR
2
Los estannenos, compuestos con dobles enlaces estaño-carbono, se ejemplifican con los derivados del estannabenceno. Los estanoles, análogos estructurales del ciclopentadieno, presentan escasa presencia de dobles enlaces C-Sn.
Derivados orgánicos de estaño(I)
Los compuestos de Sn(I) son raros y solo se observan con ligandos muy voluminosos. Una familia se obtiene mediante la pirólisis del triestannileno sustituido con 2,6-dietilfenilo [Sn(C6H3-2,6-Et2)2]3, que produce el clúster de tipo cubano y un prismano. Estas jaulas contienen Sn(I) y tienen la fórmula [Sn(C6H3-2,6-Et2)]n, donde n = 8, 10 y Et representa el grupo etilo.[10] Un estannino contiene un triple enlace entre un átomo de estaño y un átomo de carbono (p. ej., R−Sn≡C−R y R−Sn≡Si−R)), y un distannino un triple enlace entre dos átomos de estaño (R−Sn≡Sn−R). Los distanninos solo existen para sustituyentes extremadamente voluminosos. A diferencia de los alquinos, el núcleo C−Sn≡Sn−C de estos distaninos no es lineal, aunque sí plano. La distancia Sn-Sn es de 3,066(1) Å y los ángulos Sn-Sn-C son de 99,25(14)°. Estos compuestos se preparan mediante la reducción de haluros voluminosos de arilestaño(II).[11]
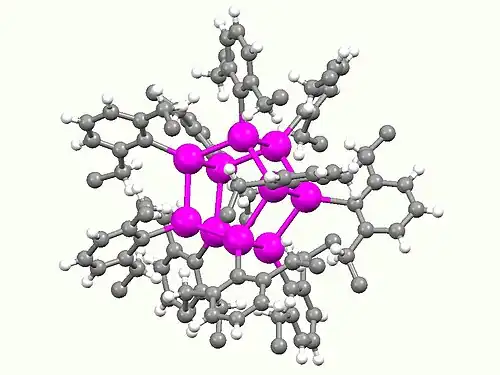
Grey balls: C
Magenta (largest) balls: Sn
Structure of an Ar
10Sn
10 "prismane", a compound containing Sn(I) (Ar = 2,6-diethylphenyl).
Preparación de compuestos orgánicos de estaño
Los compuestos orgánicos de estaño pueden ser sintetizados por reacción de un reactivo de Grignard con haluros de estaño, por ejemplo, tetracloruro de estaño. Un ejemplo es la síntesis orgánica de tributil-[(Z)-5-fenil-2-penten-2-il]estannano[12][13]
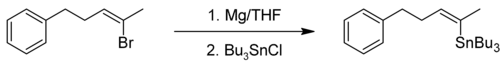
Síntesis de compuestos orgánicos de estaño.
La reacción de acoplamiento, similar a la de Wurtz, de compuestos alquílicos de sodio con haluros de estaño permite obtener compuestos de tetraorganoestaño. Otro método es un reacción de intercambio de haluros de estaño con un compuesto de organoaluminio (AlR3). Los haluros de triorganoestaño se pueden preparar en la reacción de redistribución Kocheshkov.
Reacciones de los compuestos orgánicos de estaño
Reacciones importantes en las que intervienen compuestos orgánicos de estaño son la reacción de Stille (reacción de acoplamiento con haluros orgánicos que poseen hibridación sp2, catalizada por paladio):
y la adición de organostannanos (adición nucleofílica de un alil-, alenil-, o propargil-estannano a un aldehído o imina).
Uso y toxicidad
- Los compuestos de tetraorganoestaño son moléculas muy estables, con baja toxicidad y baja actividad biológica. No se pueden utilizar como biocidas, pero puede ser metabolizados a compuestos tóxicos de triorganoestaño. Se utilizan como materiales de partida para obtener catalizadores.
- Los compuestos de triorganoestaño son muy tóxicos. Los compuestos de tri-n-alquilestaño son fitotóxicos y por lo tanto no pueden ser utilizados en la agricultura. Dependiendo de los grupos orgánicos, pueden ser bactericidas y fungicidas de gran alcance. Los compuestos de tributilestaño son utilizados como biocidas industriales, por ejemplo, como agentes antifúngicos en el sector textil y del papel, fábricas de pulpa de madera y de papel, fábricas de cerveza, y sistemas de refrigeración industrial. También se utilizan en pinturas antiincrustaciones marinas. Los compuestos de trifenilestaño se utilizan como componentes activos de las pinturas antihongos y fungicidas agrícolas. Otros compuestos de triorganoestaño se utilizan como acaricidas.
- Los compuestos de diorganoestaño no tienen actividad antifúngica, poseen baja toxicidad, y la actividad antibacteriana es baja, a excepción de los derivados de difenilestaño. Se utilizan en la fabricación de polímeros, como estabilizadores térmicos de PVC, catalizadores, en la fabricación de poliuretano y endurecedor de silicona. El DBT es, sin embargo, inmunotóxico, y un estudio reciente sugiere un vínculo con las enfermedades autoinmunes relacionadas[14]
- Los compuestos de monoorganoestaño no tienen actividad biocida y su toxicidad para los mamíferos es muy baja. Los compuestos de metilestaño, butilestaño, octilestaño y monoésterestaño son utilizados como estabilizadores térmicos del PVC.
- Muchos de los compuestos orgánicos de estaño están siendo estudiados en la terapia contra el cáncer, observando que su citotoxicidad y selectividad hacia la célula cancerosa es mayor que la del cisplatino.[15]
Compuestos
Los compuestos orgánicos de estaño se usan comercialmente en una amplia gama de aplicaciones como biocidas, insecticidas, productos químicos intermedios y catalizadores.
- Compuestos de organoestaño
-
 Compuestos de tetrabutilestaño, material de partida para los compuestos de di- y tributilo
Compuestos de tetrabutilestaño, material de partida para los compuestos de di- y tributilo -
 Óxido de tributilestaño, un líquido incoloro a amarillo pálido usado en conservación de la madera
Óxido de tributilestaño, un líquido incoloro a amarillo pálido usado en conservación de la madera -
 Acetato de trifenilestaño, un sólido cristalino blanco, utilizado como insecticida y fungicida
Acetato de trifenilestaño, un sólido cristalino blanco, utilizado como insecticida y fungicida -
 Cloruro de trifenilestaño, un sólido blanco cristalino, que se utiliza como biocida y compuesto intermedio en síntesis química
Cloruro de trifenilestaño, un sólido blanco cristalino, que se utiliza como biocida y compuesto intermedio en síntesis química -
 Cloruro de trimetilestaño también es un biocida
Cloruro de trimetilestaño también es un biocida -
 hidróxido de trifenilestaño, un polvo blanco, utilizado como fungicida y para esterilizar los insectos
hidróxido de trifenilestaño, un polvo blanco, utilizado como fungicida y para esterilizar los insectos -
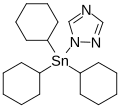 Azocicloestaño, un sólido cristalino incoloro, acaricida de larga duración para el control de la araña roja en las plantas
Azocicloestaño, un sólido cristalino incoloro, acaricida de larga duración para el control de la araña roja en las plantas -
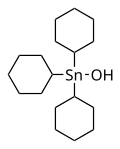 Cihexaestaño, un sólido blanco cristalino, que se utiliza como acaricida
Cihexaestaño, un sólido blanco cristalino, que se utiliza como acaricida -
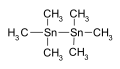 Hexametildiestaño usado como producto intermedio en síntesis química
Hexametildiestaño usado como producto intermedio en síntesis química -
![Tetraetilestaño, punto de ebullición 63–65° /12 mm Hg es un catalizador[16]](./Tetraethyltin.svg.png) Tetraetilestaño, punto de ebullición 63–65° /12 mm Hg es un catalizador[16]
Tetraetilestaño, punto de ebullición 63–65° /12 mm Hg es un catalizador[16]
Otras clasificaciones
Los poliestannanos son estannanos poliméricos del tipo (SnR2)n
Los estannoles son análogos estructurales del pirrol. También existen organoestannanos insaturados: los estannenos son compuestos del tipo RRC=SnRR con un doble enlace formal (ver también estannobenceno), y los diestannenos tiene un doble enlace estaño-estaño como en RRSn=SnRR. Un estannino contiene un triple enlace entre un átomo de carbono y otro de estaño; un diestannino posee un triple enlace entre dos átomos de estaño (RSnSnR). Los radicales estaño se llaman radicales estannilo, y los carbenos de estaño son los estannilenos (RSn:)[17]
Estannanos hipercoordinados
A diferencia de sus análogos de carbono, los compuestos orgánicos de estaño también pueden estar coordinados con cinco y hasta seis átomos en lugar de los cuatro habituales. Estos compuestos hipercoordinados suelen tener sustituyentes electronegativos para su estabilización. Los pentaorganoestannatos de litio fueron detectados por primera vez y se caracterizaron en disolución en 1986,[18] mientras que en años posteriores se informó sobre un compuesto de tetraorganoestaño de coordinación seis.[19] En 2007, se informó sobre una estructura cristalina de pentaorganoestannano estable a temperatura ambiente (en argón) en forma de sal de litio con esta estructura:[20]
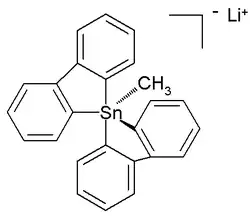
Pentaorganoestannanos.
Incluso se han caracterizado los penta- y hexaorganostannatos(IV) totalmente orgánicos,[21] mientras que en el año posterior se informó de un compuesto de tetraorganoestaño hexa-coordinado.[22] Se informó de una estructura cristalina de pentaorganostannato(IV) totalmente carbonado estable a temperatura ambiente (en argón) como la sal de litio con esta estructura:[23]
En esta estructura bipiramidal trigonal distorsionada las longitudes de enlace carbono - estaño (2,26 Å apical, 2,17 Å ecuatorial) son más grandes que los enlaces C-Sn normales (2,14 Å) lo cual refleja su naturaleza hipervalente.
Véase también
Enlaces químicos del carbono con el resto de átomos
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSb | CTe | CI | CXe | ||
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
- ↑ Sander H.L. Thoonen, Berth-Jan Deelman, Gerard van Koten (2004). «Synthetic aspects of tetraorganotins and organotin(IV) halides». Journal of Organometallic Chemistry (689): 2145-2157.
- ↑ Química de organoestaño. Técnica y síntesis en química inorgánica. Robert J. Angelici. Editorial Reverté, 1979. ISBN 8429170189. Pág. 204
- ↑ Gielen, Marcel (1973). «From kinetics to the synthesis of chiral tetraorganotin compounds». Acc. Chem. Res. 6 (6): 198-202. doi:10.1021/ar50066a004.
- ↑ «Tin, Tin Alloys, and Tin Compounds». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a27_049.
- ↑ «Stannanol».
- ↑ «Organotin assemblies containing Sn/O bonds». Coordination Chemistry Reviews 235: 1-52. 2002. doi:10.1016/S0010-8545(02)00178-9.
- ↑ «Chemistry of the Elements (2nd ed.)». Butterworth-Heinemann. 1997. ISBN 978-0-08-037941-8.
- ↑ Davies, Alwyn George. (2004) Organotin Chemistry, 2nd Edition Weinheim: Wiley-VCH. ISBN 978-3-527-31023-4
- ↑ T. V. RajanBabu, P. C. B. Page B. R. Buckley "Tri-n-butylstannane" in e-EROS Encyclopedia of Reagents for Organic Synthesis, 2004. doi 10.1002/047084289X.rt181.pub2
- ↑ Sita, Lawrence R. (1994). «Heavy-Metal Organic Chemistry: Building with Tin». Acc. Chem. Res. 27 (7): 191-197. doi:10.1021/ar00043a002.
- ↑ «Bonding and Reactivity of Heavier Group 14 Element Alkyne Analogues». Organometallics 26 (18): 4362-4372. 2007. doi:10.1021/om700365p.
- ↑ Martin J. Stoermer, John T. Pinhey (1998). «Tributyl-[(Z)-5-phenyl-2-penten-2-yl]stannane». Molecules 3: M67.
- ↑ Un Grignard reagent reactivo de Grignard se prepara a partir de virutas de magnesio y (Z)-2-bromo-5-fenil-2-penteno en tetrahidrofurano seco y se titula con cloruro de tributilestaño hasta que la disolución se decolora. La disolución resultante se agita a temperatura ambiente durante 1 hora y se elimina el disolvente en un rotavapor. Se añade éter dietílico y el extracto etéreo se lava con salmuera y se filtra y se evapora el éter en un rotavapor. El producto bruto se destila en un Kugelrohr hasta obtener tributil-[(Z)-5-fenil-2-penten-2-il]estannano como un aceite incoloro.
- ↑ C Gumy et al. (2008). «Dibutyltin Disrupts Glucocorticoid Receptor Function and Impairs Glucocorticoid-Induced Suppression of Cytokine Production». PLoS ONE 3: e3545. doi:10.1371/journal.pone.0003545.
- ↑ S. Gómez-Ruiz et al. (2008). «Study of the cytotoxic activity of di and triphenyltin(IV) carboxylate complexes». Journal of Inorganic Biochemistry 102 (12): 2087. PMID 18760840. doi:10.1016/j.jinorgbio.2008.07.009.
- ↑ Organic Syntheses, Coll. Vol. 4, p.881 (1963); Vol. 36, p.86 (1956). Enlace
- ↑ Organotin chemistry 2004 Alwyn George Davies ISBN 3-527-31023-1
- ↑ Reich, Hans J.; Phillips, Nancy H. (1986). «Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes». J. Am. Chem. Soc. 108: 2102. doi:10.1021/ja00268a067.
- ↑ V. G. Kumar Das, Lo Kong Mun, Chen Wei, and Thomas C. W. Mak (1987). «Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound». Organometallics 6: 10. doi:10.1021/om00144a003.
- ↑ Masaichi Saito, Sanae Imaizumi, Tomoyuki Tajima, Kazuya Ishimura, and Shigeru Nagase (2007). «Synthesis and Structure of Pentaorganostannate Having Five Carbon Substituents». J. Am. Chem. Soc. 129: 10974-10975. doi:10.1021/ja072478.
- ↑ Reich, Hans J.; Phillips, Nancy H. (1986). «Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes». J. Am. Chem. Soc. 108 (8): 2102-2103. doi:10.1021/ja00268a067.
- ↑ «Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound». Organometallics 6: 10-14. 1987. doi:10.1021/om00144a003.
- ↑ «Synthesis and Structure of Pentaorganostannate Having Five Carbon Substituents». J. Am. Chem. Soc. 129 (36): 10974-10975. 2007. PMID 17705378. doi:10.1021/ja072478+.