Química del organoplatino
La química del organoplatino es la química de los compuestos organometálicos que contienen un enlace químico de carbono-platino (C-Pt) y el estudio del platino como catalizador en reacciones orgánicas.[1][2][3] Los compuestos de organoplatino existen en el estado de oxidación 0 a IV, siendo el estado de oxidación II el más abundante. El orden general en fuerza de enlace es Pt-C (sp) > Pt-O > Pt-N > Pt-C (sp3). La química del organoplatino y del organopaladio es similar, pero los compuestos de organoplatino son más estables y, por lo tanto, menos útiles como catalizadores.
Organoplatino(0)
La mayoría de los compuestos de organoplatino(0) contienen ligandos de alqueno y alquino. Los complejos de carbonilo son raros y el análogo de Ni(CO)4 es difícil de conseguir. Los ligandos alqueno y alquino sirven como donantes de dos electrones, por ejemplo en los complejos (PPh3)2 Pt(C2H4) y (PPh3)2 Pt(C2Ph2). El ligando de etileno en (PPh3)2Pt(C2H4) es lábil e intercambia con alquinos y alquenos electrófilos, incluso con un fullereno C60 .
Una ruta sintética general para (PPh3)2Pt(in) (in = alqueno, alquino) es la reducción de tetracloroplatinato de potasio con hidróxido de potasio en etanol o hidrazina en presencia de un ligando de fosfina como trifenilfosfina y el alqueno o alquino. Estas reacciones se producen a través de la intermediación del cis -diclorobis(trifenilfosfina)platino(II). Los ligandos basados en nitrógeno no suelen favorecer la formación de complejos de platino de alquenos y alquinos.
Los complejos de organoplatino de valencia cero que carecen de ligandos de fosfina a menudo se preparan mediante PtCl2(COD).
- Li2C8H8 + PtCl2(COD) + 3 C7H10 → [Pt(C7H10)3] + 2 LiCl + C8H8 + C8H12
- Pt(C7H10) + 2 COD → Pt(COD)2 + 3 C7H10
donde C7H10 es el norborneno.
Organoplatino(I)
Los compuestos de platino (I) son poco comunes pero generalmente son diamagnéticos porque tienen enlaces Pt-Pt. Un ejemplo es la dicatión [Pt2(CO)6]2+.
Organoplatino(II)
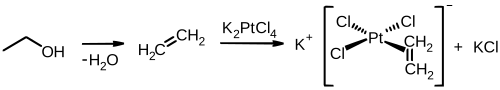
Un compuesto históricamente significativo de organoplatino (II) es la sal de Zeise, que se obtiene a partir de etileno y tetracloroplatinato de potasio:
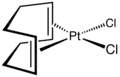
El complejo de diolefina incoloro dicloro(cicloocta-1,5-dieno)platino(II) es un compuesto más moderno y se utiliza más ampliamente como punto de partida a otros compuestos de platino mediante el desplazamiento de los ligandos COD y/o cloruro.
La estabilidad y diversidad de los complejos de alquenos de platino (II) contrastan con la rareza de los complejos de alquenos de níquel (II). Los complejos de alilo de platino también son comunes. A diferencia de la química del níquel, donde compuestos como CpNi(L)X son comunes, los derivados de ciclopentadienilo de Pt(II) son raros, lo que es coherente con la reticencia del Pt(II) a volverse pentacoordinado.
Los complejos de alquil y aril platino(II) a menudo se preparan mediante la adición oxidativa de un haluro de alquilo o haluro de arilo a un precursor de Pt(0) como tetrakis(trifenilfosfina)platino(0) o Pt(C2H4)(PPh3)2. Alternativamente, los cloruros de platino (II) son susceptibles a la alquilación:[4][5]
- PtCl 2 (SMe2)2 + 2 MeLi → PtMe2(SMe2)2 + 2 LiCl
Los ligandos de dimetilsulfuro en PtMe2(SMe2)2 pueden ser desplazados por otros ligandos.
Muchos complejos de organoplatino (II) surgen a través de la ortometalación y procesos de activación CH intramolecular relacionados.
Organoplatino(IV)
El primer compuesto de organoplatino jamás sintetizado fue el yoduro de trimetilplatino a partir de cloruro de platino (IV) y yoduro de metilmagnesio, reportado por Pope y Peachey en 1907.[6][7] El compuesto adopta una estructura similar a la del cubano con cuatro ligandos de yoduro que forman triple puente. En 1952, Henry Gilman afirmó que el "tetrametilplatino" era un derivado de este tetrámero, pero más tarde se demostró que esta afirmación era incorrecta (resultó que el "tetrametilplatino" era [PtMe3OH]4). Se han caracterizado las sales de [PtMe6] 2− y [PtMe4] 2−.[8]
Los hidruros de organoplatino (IV) son raros.[10] Los primeros representantes aislados se prepararon a partir de haluros de organoestaño o ácidos con compuestos de arilplatino (II) ortometalados. El compuesto Me(PEt3)2PtOTf reacciona reversiblemente con el ácido tríflico entre -60 y -80 °C, formándose metano y (PEt3)2Pt(OTf)2 a -20 °C. Los ácidos débiles a menudo son suficientes incluso para el agua y el alcohol y en la activación del enlace CH la fuente de protones es un alcano.
Catálisis
Los catalizadores heterogéneos basados en platino desempeñan un papel importante en la industria petroquímica, y se asume que estas reacciones útiles suceden a través de intermedios de organoplatino unidos a la superficie. Mejor definidos pero menos significativos comercialmente son los catalizadores homogéneos basados en platino.
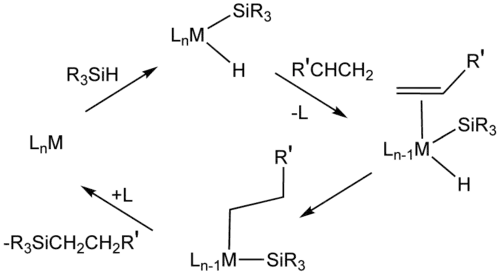
Para la hidrosililación, el ácido cloroplatínico (H2PtCl6) («catalizador de Speier») es un catalizador importante. Los mecanismos para este sistema catalítico generalmente suponen intermediarios que contienen hidruro, ligando de sililo (R3Si) y ligandos de alqueno.[11] El cis-diclorobis(sulfuro de dietilo)platino(II) y el catalizador de Karstedt (aducto de diviniltetrametildisiloxano y ácido cloroplatínico) también catalizan la hidrosililación.[12] Muchos metalodendrímeros tienen unidades repetidas basadas en compuestos de organoplatino.
Temas de investigación
Los compuestos de organoplatino están implicados en el sistema Shilov para la conversión de metano en cloruro de metilo. Se han realizado intensos esfuerzos, hasta ahora sin éxito, para extender esta reactividad a métodos prácticos para funcionalizar el metano.[13] Por ejemplo, los complejos de platino de bipirimidina catalizan la conversión de metano, oxígeno y trióxido de azufre en bisulfato de metilo.[14]
Referencias
- ↑ Nickel, Palladium and Platinum (Comprehensive Organometallic Chemistry II) R.J. Puddephatt (Editor) 2002 ISBN: 0080423167
- ↑ Synthesis of Organometallic Compounds: A Practical Guide Sanshiro Komiya Ed. S. Komiya, M. Hurano 1997 ISBN: 978-0-471-97195-5
- ↑ Jwu-Ting Chen "Platinum: Organometallic Chemistry" in Encyclopedia of Inorganic Chemistry 2006, John Wiley & Sons, New York. doi 10.1002/0470862106.ia195
- ↑ Costa, E.; Pringle, P. G.; Ravetz, M. (1997). [(1,2,5,6-N)-1,5-Cyclooctadiene]Dimethyl-Platinum(II). Inorganic Syntheses 31. p. 284. ISBN 978-0-470-13262-3. doi:10.1002/9780470132623.ch49.
- ↑ Hill, Geoffrey S.; Irwin, Michael J.; Levy, Christopher J.; Rendina, Louis M.; Puddephatt, Richard J. (1998). Platinum(II) Complexes of Dimethyl Sulfide. Inorganic Syntheses 32. p. 149. ISBN 978-0-470-13263-0. doi:10.1002/9780470132630.ch25.
- ↑ «Proceedings of the Chemical Society, Vol. 23, No. 323». Proceedings of the Chemical Society (London) 23 (323): 81-94. 1907. doi:10.1039/PL9072300081.
- ↑ Pope, W. J.; Peachey, S. J. (1909). «LXXIII.?The alkyl compounds of platinum». Journal of the Chemical Society, Transactions 95: 571-576. doi:10.1039/CT9099500571.
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ Ebert, K. H.; Massa, W.; Donath, H.; Lorberth, J.; Seo, B. S.; Herdtweck, E. (1998). «Organoplatinum Compounds: VI. Trimethylplatinum Thiomethylate and Trimethylplatinum Iodide. The Crystal Structures of [(CH3)3PtS(CH3)]4 and [(CH3)3PtI]4·0.5CH3I». J. Organomet. Chem. 559 (1–2): 203-207. doi:10.1016/S0022-328X(98)00414-8.
- ↑ Puddephatt, R. (2001). «Platinum(IV) hydride chemistry». Coordination Chemistry Reviews. 219–221: 157-185. doi:10.1016/S0010-8545(01)00325-3.
- ↑ C. Elschenbroich, Organometallics (2006) Wiley and Sons-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ Kettler, P. B. (2003). «Platinum Group Metals in Catalysis: Fabrication of Catalysts and Catalyst Precursors». Organic Process Research & Development 7 (3): 342-354. doi:10.1021/op034017o.
- ↑ Stahl, Shannon S.; Labinger, Jay A.; Bercaw, John E. (1998). «Homogeneous Oxidation of Alkanes by Electrophilic Late Transition Metals». Angewandte Chemie International Edition 37 (16): 2180-2192. PMID 29711451. doi:10.1002/(SICI)1521-3773(19980904)37:16<2180::AID-ANIE2180>3.0.CO;2-A.
- ↑ Brian G. Hashiguchi; Steven M. Bischof; Michael M. Konnick; Roy A. Periana (2012). «Designing Catalysts for Functionalization of Unactivated C–H Bonds Based on the CH Activation Reaction». Acc. Chem. Res. 45 (6): 885-898. PMID 22482496. doi:10.1021/ar200250r.