Cloruro de vanadio(III)
| Cloruro de vanadio(III) | ||
|---|---|---|
 Anhidro | ||
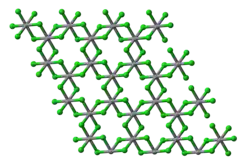 Modelo de bola y palo de una sola capa (vista en planta) en la estructura cristalina del cloruro de vanadio(III), VCl3. | ||
| Nombre IUPAC | ||
|
Cloruro de vanadio(III) Tricloruro de vanadio | ||
| General | ||
| Fórmula molecular | VCl3 | |
| Identificadores | ||
| Número CAS | 7718-98-1[1] | |
| Número RTECS | YW2800000 | |
| ChemSpider | 56399 10801024, 56399 | |
| PubChem | 62647 | |
| Propiedades físicas | ||
| Densidad | 2800 kg/m³; 2,8 g/cm³ | |
| Masa molar | 155,850518 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de vanadio(III) es un compuesto inorgánico de fórmula VCl3 y sus hidratos. Forma un anhidro púrpura y un hexahidrato verde [VCl2(H2O)4]Cl·2H2O. Estas sales higroscópicas son precursoras comunes de otros complejos de vanadio(III) y se utilizan como agentes reductores suaves. [2]
Estructura y configuración electrónica
El VCl3 tiene la estructura del BiI3 en capas. Presenta un armazón de cloruro empaquetado hexagonalmente con los iones vanadio ocupando los huecos octaédricos.[3] El VBr3 y el VI3 adoptan la misma estructura. Sin embargo, el VF3 presenta una estructura más relacionada con el ReO3.[4]
El catión V3+ tiene una configuración electrónica d 2 con dos electrones no apareados, por lo que el compuesto es paramagnético.[5]
El VCl3 es un aislante de Mott y experimenta una transición antiferromagnética a bajas temperaturas.[3] [6]
El hexahidrato sólido [VCl2(H2O)4]Cl-2H O tiene una estructura cristalina monoclínica y consta de centros trans-[VCl2(H2O)4]+ octaédricos ligeramente distorsionados, así como cloruro y dos moléculas de agua de cristalización.[7][8] La fase hexahidratada pierde dos veces el agua de cristalización para formar el tetrahidrato si se calienta a 90 °C en una corriente de gas cloruro de hidrógeno. [9]


4_Cl%C2%B72H2O.png)
Usos
Las soluciones de cloruro de vanadio(III) en ácido sulfúrico y ácido clorhídrico se utilizan como electrolitos en baterías de vanadio redox, [10]así como en síntesis orgánica como ácido de Lewis suave. Un ejemplo de ello es su uso como catalizador en la escisión del grupo acetónido.[11]Otro ejemplo de su uso como agente reductor se encuentra en la determinación de la concentración de nitrato y nitrito en el agua, donde el VCl3 reduce el nitrato a nitrito. Este método es una alternativa más segura al método de la columna de cadmio. [12]
Preparación
El VCl3 se prepara calentando el VCl4 a 160–170 °C bajo una corriente de gas inerte que barre el Cl2. El líquido rojo brillante se convierte en un sólido púrpura. [13]
Los óxidos de vanadio también se pueden utilizar para producir cloruro de vanadio (III). Por ejemplo, el óxido de vanadio(III) reacciona con cloruro de tionilo a 200 °C: [13]
- V2O3 + 3 SOCl2 → 2 VCl3 + 3 SO2
La reacción del óxido de vanadio(V) y el dicloruro de disulfuro también produce cloruro de vanadio(III) con liberación de dióxido de azufre y azufre. [13]
El hexahidrato puede prepararse por evaporación de soluciones acuosas ácidas del tricloruro. [9]
Reacciones
Al calentar VCl3 se descompone con volatilización del VCl4, dejando VCl2 por encima de 350 °C.[14]
Al calentar bajo H2 a 675 °C (pero menos de 700 °C), el VCl3 se reduce a VCl2 verdoso.
- 2 VCl3 + H2 → 2 VCl2 + 2 HCl
La comproporcionación de tricloruro de vanadio y óxidos de vanadio(V) da oxidicloruro de vanadio: [15]
- V2O5 + VOCl3 + 3 VCl3 → 6 VOCl2
Al calentar el hexahidrato, no se obtiene la forma anhidra, sino que sufre una hidrólisis parcial y se forma oxicloruro de vanadio a 160 °C. En atmósfera inerte, forma un trihidrato a 130 °C y, a temperaturas más elevadas, se obtiene oxicloruro de vanadio.[16]
El tricloruro de vanadio cataliza la reacción de acoplamiento del pinacol de benzaldehído (PhCHO) a 1,2-difenil-1,2-etanodiol mediante varios metales reductores como el zinc: [17]
- Zn + 2 H2O + 2 PhCHO → (PhCH(OH))2 + Zn(OH)2
Referencias
- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ a b Wilhelm Klemm; Ehrhard Krose (1947). «Die Kristallstrukturen von ScCl3, TiCl3 und VCl3» [The Crystal Structures of ScCl3, TiCl3 and VCl3]. Zeitschrift für anorganische Chemie (en alemán) 253 (3–4): 218-225. doi:10.1002/zaac.19472530313.
- ↑ Wilhelm Klemm; Ehrhard Krose (1947). «Die Kristallstrukturen von ScCl3, TiCl3 und VCl3» [The Crystal Structures of ScCl3, TiCl3 and VCl3]. Zeitschrift für anorganische Chemie (en alemán) 253 (3–4): 218-225. doi:10.1002/zaac.19472530313.
- ↑ Greenwood, N. N. and Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. p. 990 ISBN 0-7506-3365-4.
- ↑ Starr, C.; Bitter, F.; Kaufmann, A. R. (1 de diciembre de 1940). «The Magnetic Properties of the Iron Group Anhydrous Chlorides at Low Temperatures. I. Experimental». Physical Review 58 (11): 977-983. Bibcode:1940PhRv...58..977S. doi:10.1103/PhysRev.58.977.
- ↑ Fiona H. Fry; Brenda Dougan; Nichola McCann; Anthony C. Willis; Christopher J. Ziegler; Nicola E. Brasch (2008). «Synthesis and X-ray structural characterization of tris(l-glycinato)vanadium(III) and trans-tetraquadichlorovanadium(III) chloride». Inorganica Chimica Acta (en inglés) 361 (8): 2321-2326. doi:10.1016/j.ica.2007.11.025.
- ↑ Fiona H. Fry; Brenda Dougan; Nichola McCann; Anthony C. Willis; Christopher J. Ziegler; Nicola E. Brasch (2008). «Synthesis and X-ray structural characterization of tris(l-glycinato)vanadium(III) and trans-tetraquadichlorovanadium(III) chloride». Inorganica Chimica Acta (en inglés) 361 (8): 2321-2326. doi:10.1016/j.ica.2007.11.025.
- ↑ a b Sally M. Horner; S. Y. Tyree (1964). «Chloro-Aquo Complexes of Vanadium(III)». Inorganic Chemistry (en inglés) 3 (8): 1173-1176. doi:10.1021/ic50018a024.
- ↑ Günter Bauer; Volker Güther; Hans Hess; Andreas Otto; Oskar Roidl; Heinz Roller; Siegfried Sattelberger; Sven Köther-Becker et al. (2017). Vanadium and Vanadium Compounds (en inglés). Wiley-VCH Verlag GmbH & Co. KGaA. p. 16. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a27_367.pub2.
- ↑ Gowravaram Sabitha; G.S. Kiran Kumar Reddy; K. Bhaskar Reddy; N. Mallikarjuna Reddy; J.S. Yadav (2005). «Vanadium(III) chloride: A mild and efficient catalyst for the chemoselective deprotection of acetonides». Journal of Molecular Catalysis A: Chemical (en inglés) 238 (1–2): 229-232. doi:10.1016/j.molcata.2005.05.028.
- ↑ Bernhard Schnetger; Carola Lehners (2014). «Determination of nitrate plus nitrite in small volume marine water samples using vanadium(III)chloride as a reduction agent». Marine Chemistry (en inglés) 160: 91-98. Bibcode:2014MarCh.160...91S. doi:10.1016/j.marchem.2014.01.010.
- ↑ a b c Georg Brauer (1975). Handbuch der präparativen anorganischen Chemie Volume 3 (en alemán). the University of Michigan: Enke. p. 1409. ISBN 978-3-432-87823-2.
- ↑ Young, Ralph C.; Smith, Maynard E.; Moeller, Therald; Gordon, Paul G.; McCullough, Fred (2007). «Vanadium(III) Chloride». Inorganic Syntheses. pp. 128-130. ISBN 978-0-470-13235-7. doi:10.1002/9780470132357.ch43.
- ↑ G. Brauer (1963). «Vanadium Oxydichloride». En G. Brauer, ed. Handbook of Preparative Inorganic Chemistry, 2nd Ed. NY: Academic Press. p. 1263.
- ↑ Ray Colton; J. H. Canterford (1969). Halides of the first row transition metals (en inglés). Wiley. p. 131. ISBN 978-0-471-16625-2.
- ↑ Xu; Hirao, Toshikazu (2005). «Vanadium-Catalyzed Pinacol Coupling Reaction in Water». The Journal of Organic Chemistry 70 (21): 8594-8596. PMID 16209617. doi:10.1021/jo051213f.
Enlaces externos
- Esta obra contiene una traducción derivada de «Vanadium(III) chloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.