Trióxido de renio
| Trióxido de renio | ||
|---|---|---|
|
| ||
 | ||
| General | ||
| Fórmula molecular | REO3 | |
| Identificadores | ||
| Número CAS | 1314-28-9[1] | |
| ChemSpider | 92247 | |
| PubChem | 102110 | |
| UNII | FET0Y2C413 | |
| Propiedades físicas | ||
| Densidad | 6920 kg/m³; 6,92 g/cm³ | |
| Masa molar | 234,94 g/mol | |
| Punto de fusión | 673 K (400 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El trióxido de renio es un compuesto inorgánico de este metal, de fórmula REO3. Es un sólido rojo de brillo metálico que se asemeja al cobre. Es el único trióxido estable de los elementos del grupo 7 (Mn, Tc, Re).
Preparación y estructura
El trióxido de renio puede formarse mediante la reducción del óxido de renio(VII) con monóxido de carbono a 200 °C o del renio elemental a 400 °C. [2]
- Re2O7 + CO → 2 ReO3 + CO2
- 3 Re2O7 + Re → 7 ReO3
El Re2O7 también se puede reducir con dioxano . [3]
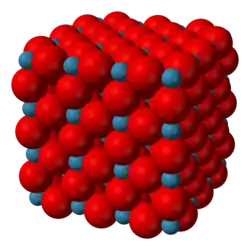
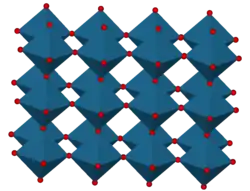
El trióxido de renio cristaliza con una celda unitaria cúbica primitiva, con un parámetro de red de 3,742 Å (374,2 pm). La estructura del ReO3 es similar a la de la perovskita (ABO3), pero sin el gran catión A en el centro de la celda unitaria. Cada centro de renio está rodeado por un octaedro definido por seis centros de oxígeno. Estos octaedros comparten vértices para formar la estructura tridimensional. El número de coordinación del O es 2, ya que cada átomo de oxígeno tiene 2 átomos de Re vecinos.[4]
Propiedades
Propiedades físicas
El ReO3 es inusual para un óxido porque exhibe una resistividad muy baja. Se comporta como un metal en el sentido de que su resistividad disminuye a medida que disminuye su temperatura. A 300 K, su resistividad es de 100,0 nΩ·m, mientras que a 100 K, ésta disminuye a 6,0 nΩ·m, 17 veces menos que a 300 K. [4]
Propiedades químicas
El trióxido de renio es insoluble en agua, así como en ácidos y bases diluidos. Al calentarlo en una base se produce una dismutación que da ReO
2 y ReO−
4, mientras que la reacción con ácido a alta temperatura produce Re
2O
7. En ácido nítrico concentrado, produce ácido perrénico. Al calentar a 400 °C al vacío, sufre una dismutación: [3]
- 3 ReO3 → Re2O7 + ReO2
El trióxido de renio se puede clorar para dar cloruro de trióxido de renio : [5]
- 2 ReO
3 + Cl
2 → 2 ReO
3Cl
Usos
Catalizador de hidrogenación
El trióxido de renio encuentra algún uso en la síntesis orgánica como catalizador para la reducción de amidas. [6]
Referencias
- ↑ Número CAS
- ↑ H. Nechamkin, C. F. Hiskey, "Rhenium(VI): Oxide (Rhenium Trioxide)" Inorganic Syntheses, 1950 Volume 3, pp. 186-188. doi 10.1002/9780470132340.ch49
- ↑ a b O. Glemser; R. Sauer (1963). «Rhenium(VI) Oxide». En G. Brauer, ed. Handbook of Preparative Inorganic Chemistry, 2nd Ed. 2pages=1482. NY, NY: Academic Press.
- ↑ a b Greenwood, Norman N. (1997). Chemistry of the Elements. Butterworth-Heinemann. p. 1047. ISBN 978-0-08-037941-8.
- ↑ O. Glemser; R. Sauer (1963). «Rhenium (VII) Oxychloride». En G. Brauer, ed. Handbook of Preparative Inorganic Chemistry, 2nd Ed. 2pages=1480. NY, NY: Academic Press.
- ↑ Nishimura, Shigeo (2001). Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis (1st edición). New York: Wiley-Interscience. p. 408. ISBN 9780471396987.
Enlaces externos
- Esta obra contiene una traducción derivada de «Rhenium trioxide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.