Tetracloruro de vanadio
| Tetracloruro de vanadio | ||
|---|---|---|
| Nombre IUPAC | ||
|
Tetracloruro de vanadio Cloruro de vanadio(IV) | ||
| General | ||
| Fórmula estructural |
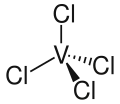 | |
| Fórmula molecular | VCl4 | |
| Identificadores | ||
| Número CAS | 7632-51-1[1] | |
| Número RTECS | YW2625000 | |
| ChemSpider | 22693 | |
| PubChem | 9837014 24273, 9837014 | |
| UNII | 2I17MGM5YJ | |
| Propiedades físicas | ||
| Densidad | 1816 kg/m³; 1,816 g/cm³ | |
| Masa molar | 190,81937022 g/mol | |
| Punto de fusión | 248,7 K (−24 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tetracloruro de vanadio es el compuesto inorgánico con la fórmula VCl4. Este líquido de color marrón rojizo se utiliza como reactivo para preparar otros compuestos de vanadio.
Síntesis, enlace y propiedades básicas
Con un electrón de valencia más que el TiCl4 diamagnético, el VCl4 es un líquido paramagnético. Es uno de los pocos compuestos paramagnéticos que son líquidos a temperatura ambiente
El VCl4 se obtiene mediante cloración del vanadio metálico. En esta reacción no se forma VCl5, ya que el Cl2 carece de poder oxidante para atacar al VCl4. Sin embargo, el VCl5 puede prepararse indirectamente a partir del VF5 a -78 °C. [2]
Reacciones
De acuerdo con su alto poder oxidante, el VCl4 reacciona con el HBr a -50 °C para producir VBr3. La reacción continúa a través del VBr4, que libera Br2 al calentarse a temperatura ambiente. [3]
- 2 C6H5OH + 2 VCl4 → HOC6H4–C6H4OH + 2 VCl3 + 2 HCl
El VCl4 forma aductos con muchos ligandos donantes, por ejemplo, VCl4(THF)2.
Es el precursor del dicloruro de vanadoceno.
Química orgánica
En síntesis orgánica, el VCl4 se utiliza para el acoplamiento oxidativo de fenoles. Por ejemplo, convierte el fenol en una mezcla de bifenoles 4,4'-, 2,4'- y 2,2'-: [4]
- 2 VCl4 + 8 HBr → 2 VBr3 + 8 HCl + Br2
Aplicaciones
El VCl4 es un catalizador para la polimerización de alquenos, especialmente los útiles en la industria del caucho. La tecnología subyacente está relacionada con la catálisis de Ziegler-Natta, que implica la intermediación de alquilos de vanadio.
Consideraciones de seguridad
El VCl4 es un oxidante volátil y agresivo que se hidroliza fácilmente para liberar HCl.
Referencias
- ↑ Número CAS
- ↑ Tamadon, Farhad; Seppelt, Konrad (2013). «The Elusive Halides VCl5, MoCl6, and ReCl6». Angew. Chem. Int. Ed. 52 (2): 767-769. PMID 23172658. doi:10.1002/anie.201207552.
- ↑ Calderazzo, F.; Maichle-Mössmer, C.; G., Pampaloni; J., Strähle (1993). «Low-temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange». Dalton Transactions (5): 655-8. doi:10.1039/DT9930000655.
- ↑ O’Brien, M. K. (2001). «Vanadium(IV) Chloride». En Paquette, L., ed. Encyclopedia of Reagents for Organic Synthesis. New York, NY: J. Wiley & Sons. ISBN 0471936235. doi:10.1002/047084289X.rv001.
Enlaces externos
- Esta obra contiene una traducción derivada de «Vanadium tetrachloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.