Cloruro de titanio(II)
| Cloruro de titanio(II) | ||
|---|---|---|
 | ||
| General | ||
| Fórmula molecular | TiCl₂ | |
| Identificadores | ||
| Número CAS | 10049-06-6[1] | |
| ChemSpider | 59613 8466246, 59613 | |
| PubChem | 10290777 66228, 10290777 | |
| UNII | BK26WI342Q | |
| Propiedades físicas | ||
| Masa molar | 117,886 g/mol | |
El cloruro de titanio(II) es un compuesto químico de fórmula TiCl₂. Este sólido negro solo se ha estudiado moderadamente, probablemente debido a su alta reactividad.[2] El Ti(II) es un fuerte agente reductor con gran afinidad por el oxígeno, que reacciona irreversiblemente con el agua para producir hidrógeno. Su preparación habitual es la desproporción térmica de TiCl₃ a 500 °C. La reacción se produce por la pérdida de TiCl₄ volátil:
- 2 TiCl3 → TiCl2 + TiCl4
El método es similar al de la conversión de VCl3 en VCl2 y VCl4 .
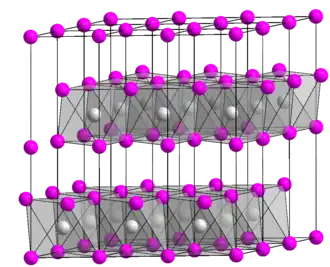
El TiCl2 cristaliza como la estructura estratificada CdI2. Así, los centros de Ti(II) están coordinados octaédricamente a seis ligandos cloruro. [3] [4]
Derivados
Se conocen complejos moleculares como TiCl2 (chel)2, donde chel es DMPE (CH3)2 PCH2 CH2 P(CH3)2 y TMEDA ((CH3)2 NCH2CH2N(CH3)2). [5] Estas especies se preparan mediante reducción de complejos relacionados Ti(III) y Ti(IV).
Se han observado efectos electrónicos inusuales en estas especies: TiCl2[(CH3)2PCH2CH2P(CH3)2]2 es paramagnético con un estado fundamental triplete, pero Ti(CH3)2[(CH3)2PCH2CH2P(CH3)2]2 es diamagnético. [6]
Un derivado de estado sólido de TiCl2 es Na2 TiCl4, que se ha preparado mediante la reacción del metal Ti con TiCl3 en un flujo de NaCl.[7]Esta especie adopta una estructura de cadena lineal en la que nuevamente los centros Ti(II) son octaédricos con haluros axiales terminales. [8]
Referencias
- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ↑ Gal'perin, E. L.; Sandler, R. A. (1962). «TiCI2». Kristallografiya 7: 217-19.
- ↑ Baenziger, N. C.; Rundle, R. E. (1948). «TiCI2». Acta Crystallogr. 1 (5): 274. doi:10.1107/S0365110X48000740.
- ↑ Girolami, G. S.; Geoffrey Wilkinson|Wilkinson, G.; Galas, A. M. R.; Thornton-Pett, M.; Hursthouse, M. B. (1985). «Synthesis and properties of the divalent 1,2-bis(dimethylphosphino)ethane (dmpe) complexes MCl2(dmpe)2 and MMe2(dmpe)2 (M = Ti, V, Cr, Mn, or Fe). X-Ray crystal structures of MCl2(dmpe)2 (M = Ti, V, or Cr), MnBr2(dmpe)2, TiMe1.3Cl0.7(dmpe)2, and CrMe2(dmpe)2». J. Chem. Soc., Dalton Trans. (7): 1339-1348. doi:10.1039/dt9850001339.
- ↑ Jensen, J. A.; Wilson, S. R.; Schultz, A. J.; Girolami, G. S. (1987). «Divalent Titanium Chemistry. Synthesis, Reactivity, and X-ray and Neutron Diffraction Studies of Ti(BH4)2(dmpe)2 and Ti(CH3)2(dmpe)2». J. Am. Chem. Soc. 109 (26): 8094-5. doi:10.1021/ja00260a029.
- ↑ Hinz, D. J.; Dedecke, T.; Urland, W.; Meyer, G. (1994). «Synthese, Kristallstruktur und Magnetismus von Natriumtetrachlorotitanat(lI), Na2TiCI4». Zeitschrift für Anorganische und Allgemeine Chemie 620 (5): 801-804. doi:10.1002/zaac.19946200507.
- ↑ Jongen, L.; Gloger, T.; Beekhuizen, J.; Meyer, G. (2005). «Divalent titanium: The halides ATiX3 (A = K, Rb, Cs; X = Cl, Br, I)». Zeitschrift für Anorganische und Allgemeine Chemie 631 (2–3): 582-586. doi:10.1002/zaac.200400464.
Enlaces externos
- Esta obra contiene una traducción derivada de «Titanium(II) chloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.