Cloruro de vanadio(II)
| Cloruro de vanadio(II) | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula molecular | VCl2 | |
| Identificadores | ||
| Número CAS | 10580-52-6[1] | |
| Número RTECS | YW1575000 | |
| ChemSpider | 59733 | |
| PubChem | 10313129 66355, 10313129 | |
| UNII | 5V2RJ2EWG4 | |
| Propiedades físicas | ||
| Densidad | 3230 kg/m³; 3,23 g/cm³ | |
| Masa molar | 120,881665 g/mol | |
| Punto de fusión | 1027 °C (1300 K) | |
| Punto de ebullición | 1506 °C (1779 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de vanadio(II) es el compuesto inorgánico de fórmula VCl2 y es el cloruro de vanadio más reducido. Es un sólido de color verde manzana que se disuelve en agua para dar soluciones de color púrpura. [2]
Preparación, propiedades y compuestos relacionados
El VCl2 sólido se obtiene mediante descomposición térmica del VCl3, que deja como residuo VCl2: [2]
- 2 VCl3 → VCl2 + VCl4
El VCl2 se disuelve en agua para dar el ion hexaaquo púrpura [V(H2O)6]2+. La evaporación de dichas soluciones produce cristales de [V(H2O)6]Cl2.[3]
El dicloruro de vanadio se utiliza como reductor especial en química orgánica. En solución acuosa, convierte el ciclohexilnitrato en ciclohexanona. También reduce la fenilazida a anilina.[4]
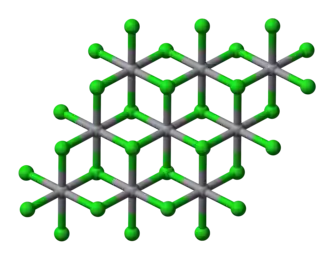
Estructura
El VCl2 sólido adopta la estructura del yoduro de cadmio, con geometría de coordinación octaédrica. Los compuestos VBr2 y VI2 son estructural y químicamente similares al dicloruro. Todos tienen la configuración d3 y un estado fundamental cuaternario, similar al del Cr(III). [5]
Referencias
- ↑ Número CAS
- ↑ a b Young, R. C.; Smith, M. E. "Vanadium(II) Chloride" Inorganic Syntheses, 1953, volume IV, page 126-127.doi 10.1002/9780470132357.ch42
- ↑ Martin Pomerantz, Gerald L. Combs, N. L. Dassanayake, "Vanadium Dichloride Solution" Inorganic Syntheses, 1982, vol. XXI, pp. 185–187. doi 10.1002/9780470132524.ch42
- ↑ Vanasse, Benoit; O'Brien, Michael K. (2001). «Vanadium(II) Chloride». Encyclopedia of Reagents for Organic Synthesis. ISBN 0471936235. doi:10.1002/047084289X.rv002.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
Enlaces externos
- Esta obra contiene una traducción derivada de «Vanadium(II) chloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.