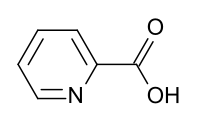
Ácido picolínico
| Ácido picolínico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido piridin-2-carboxílico | ||
| General | ||
| Fórmula molecular | C6H5NO2 | |
| Identificadores | ||
| Número CAS | 98-98-6[1] | |
| ChEBI | CHEBI:28747 | |
| ChEMBL | CHEMBL72628 | |
| ChemSpider | 993 | |
| PubChem | 1018 | |
| UNII | QZV2W997JQ | |
| KEGG | C10164 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1526 kg/m³; 1,526 g/cm³ | |
| Masa molar | 123,111 g/mol | |
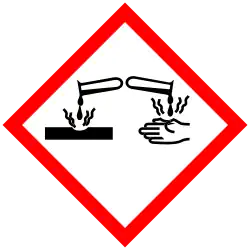
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido picolínico es un compuesto orgánico de la familia de los ácidos carboxílicos aromáticos con la fórmula NC
5H
4CO
2H. Es un derivado de la piridina con un sustituyente de ácido carboxílico (COOH) en la posición 2. Es un isómero del ácido nicotínico y del ácido isonicotínico, que tienen el grupo carboxilo en las posiciones 3 y 4, respectivamente. Es un sólido blanco, aunque las muestras impuras pueden aparecer de color canela. El compuesto es soluble en agua.
Producción
A escala comercial, el ácido picolínico se produce mediante amoxidación de 2-picolina seguida de hidrólisis del nitrilo resultante:
- NC
5H
4CH
3 + 1.5 O
2 + NH
3 → NC
5H
4C≡N + 3 H
2O - NC
5H
4C≡N + 2 H
2O → NC
5H
4CO
2H + NH
3
También se produce por oxidación de la picolina con ácido nítrico.
En el laboratorio, el ácido picolínico se forma a partir de 2-metilpiridina por oxidación con permanganato de potasio (KMnO4).[2][3]
Reacciones
La hidrogenación del ácido picolínico produce ácido piperidin-2-carboxílico, un precursor del fármaco mepivacaína.
Es un sustrato en la reacción de Mitsunobu. En la reacción de Hammick, el ácido picolínico reacciona con cetonas para dar piridina-2-carbonoles:[4]
- NC
5H
4CO
2H + R
2C=O → NC
5H
4CR
2(OH) + CO
2
Propiedad quelante
El ácido picolínico es un agente quelante bidentado de elementos como el cromo, zinc, manganeso, cobre, hierro y molibdeno en el cuerpo humano.[5][6]
Se cree que el picolinato forma un complejo con el zinc que facilita el paso de este último a través de las membranas biológicas, permitiéndole pasar del lumen intestinal al torrente sanguíneo. Un estudio en ratas demostró que el ácido picolínico en la dieta aumentaba la renovación y excreción de zinc.[7] Otros resultados sugieren también una interacción con otros metales.[8]
El complejo de picolinato de cromo (III) es lipofílico y acelera la producción de masa muscular a expensas de la masa grasa.[9] Este compuesto se vende como suplemento dietético para este fin, aunque su consumo frecuente supone riesgos para la salud. De hecho, los compuestos de cromo son relativamente estables y se ha demostrado que pueden penetrar dentro de las células y dañar el ADN.[10] Las pruebas realizadas en moscas de la fruta han demostrado que el picolinato de cromo puede causar trastornos genéticos.[11]
Biosíntesis
El ácido picolínico es un catabolito del aminoácido triptófano a través de la vía de la quinurenina.[12] Su función no está clara, pero se la ha relacionado con diversos efectos neuroprotectores, inmunológicos y antiproliferativos. Además, se sugiere ayudar en la absorción de iones de zinc (II) y otros iones divalentes o trivalentes a través del intestino delgado.[13]
Picolinatos
Las sales del ácido picolínico (picolinatos) incluyen:
- Picolinato de cromo (III)
- Picolinato de zinc
Véase también
Referencias
- ↑ Número CAS
- ↑ Singer, Alvin W.; McElvain, S. M. (1940). «Picolinic Acid Hydrochloride». Organic Syntheses 20: 79. doi:10.15227/orgsyn.020.0079.
- ↑ Harold Hart, Leslie E. Craine, David J. Hart, Christopher M. Hadad; Nicole Kindler (2007). 'Organische Chemie 3. Auflage. Weinheim: Wiley-VCH. p. 494. ISBN 978-3-527-31801-8.
- ↑ Fuchs, Philip L. (29 de julio de 2013). «Picolinic acid». Catalytic Oxidation Reagents. Wiley Inc. p. 495ff. ISBN 9781118704844. OCLC 954583821.
- ↑ Lumme, Paavo; Lundgren, Georg; Mark, Wanda; Lundström, Hans; Borch, Gunner; Craig, J. Cymerman (1969). «The Crystal Structure of Zinc Picolinate Tetrahydrate, Zn(C6H4O2N)2(H2O)4». Acta Chemica Scandinavica 23: 3011-3022. doi:10.3891/acta.chem.scand.23-3011.
- ↑ Daugulis, Olafs; Roane, James; Tran, Ly Dieu (2015). «Bidentate, Monoanionic Auxiliary-Directed Functionalization of Carbon–Hydrogen Bonds». Accounts of Chemical Research 48 (4): 1053-1064. PMC 4406856. PMID 25756616. doi:10.1021/ar5004626.
- ↑ Evans GW, Johnson EC (1981). «Effect of iron, vitamin B-6 and picolinic acid on zinc absorption in the rat». J. Nutr. 111 (1): 68-75. PMID 7452375.
- ↑ Aggett PJ, Fenwick PK, Kirk H (1989). «An in vitro study of the effect of picolinic acid on metal translocation across lipid bilayers». J. Nutr. 119 (10): 1432-7. PMID 2585133.
- ↑ G. W. Evans en D. J. Pouchnik, (1993). «Composition and biological activity of chromium-pyridine carboxylate complexes». Journal of Inorganic Biochemistry 49: 177-187.
- ↑ J. Kristopher Speetjens et al. (1999). «The Nutritional Supplement Chromium(III) Tris(picolinate) Cleaves DNA». Chem. Res. Toxicol. 12: 483-487.
- ↑ Dontarie M. Stallings et al. (2006). «Nutritional supplement chromium picolinate generates chromosomal aberrations and impedes progeny development in Drosophila melanogaster». Mutation Research/Genetic Toxicology and Environmental Mutagenesis 610: 101-113.
- ↑ Tan, L. (December 2012). «The kynurenine pathway in neurodegenerative diseases: mechanistic and therapeutic considerations». J Neurol Sci 323 (1–2): 1-8. PMID 22939820. doi:10.1016/j.jns.2012.08.005.
- ↑ Evans, Gary (1982). «The Role of Picolinic Acid in Metal Metabolism». Life Chemistry Reports (Harwood Academic Publishers) 1: 57-67. Archivado desde el original el 26 de enero de 2016. Consultado el 20 de marzo de 2015.
