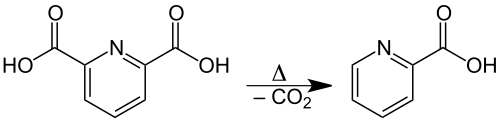Ácido dipicolínico
| Ácido dipicolínico | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Ácido 2,6-dipiridincarboxílico | ||
| General | ||
| Fórmula molecular | C7H5NO4 | |
| Identificadores | ||
| Número CAS | 499-83-2[1] | |
| ChEBI | CHEBI:46837 | |
| ChEMBL | CHEMBL284104 | |
| ChemSpider | 9940 | |
| DrugBank | DB04267 | |
| PubChem | 10367 | |
| UNII | UE81S5CQ0G | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Masa molar | 167,12 g/mol | |
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido dipicolínico (ácido piridina-2,6-dicarboxílico o PDC o DPA) es un compuesto químico que juega un papel en la termorresistencia de las endosporas bacterianas. También se utiliza para preparar complejos de lantánidos y metales de transición ligados con dipicolinato para cromatografía iónica.
Propiedades químicas
Cuando el ácido dipicolínico se calienta, se descompone a una temperatura de 248 °C mediante descarboxilación en ácido picolínico:
Papel biológico
El ácido dipicolínico compone entre el 5% y el 15% del peso seco de las esporas de Bacillus subtilis.[2] Se le ha implicado como responsable de la resistencia al calor de la endospora,[2] aunque se han aislado mutantes resistentes al calor pero que carecen de ácido dipicolínico, lo que sugiere que hay otros mecanismos que contribuyen a la resistencia al calor en juego. Se sabe que dos géneros de patógenos bacterianos producen endosporas: el aeróbico Bacillus y el anaeróbico Clostridium.
El ácido dipicolínico forma un complejo con iones de calcio dentro del núcleo de la endospora. Este complejo une las moléculas de agua libres, provocando la deshidratación de la espora. Como resultado, la resistencia térmica de las macromoléculas dentro del núcleo aumenta. El complejo de ácido dipicolínico-calcio también funciona para proteger al ADN de la desnaturalización térmica insertándose entre las nucleobases, aumentando así la estabilidad del ADN.
Detección
La alta concentración de DPA y su especificidad en las endosporas bacterianas lo han convertido durante mucho tiempo en un objetivo principal en los métodos analíticos para la detección y medición de endosporas bacterianas. Un desarrollo particularmente importante en esta área fue la demostración por Rosen et al. de un ensayo para DPA basado en fotoluminiscencia en presencia de terbio,[3] aunque este fenómeno fue investigado por primera vez para usar DPA en un ensayo para terbio por Barela y Sherry.[4]
Comportamiento ambiental
Las piridinas sustituidas simples varían significativamente en las características del destino ambiental, como la volatilidad, la adsorción y la la biodegradación.[5] El ácido dipicolínico es uno de los piridinas simples menos volátiles, menos adsorbidos por el suelo y más rápidamente degradados.[6] Varios estudios han confirmado que el ácido dipicolínico es biodegradable en ambientes aeróbicos y anaeróbicos, lo que es coherente con la amplia presencia del compuesto en la naturaleza. Con una alta solubilidad (5 g/litro) y una sorción limitada (Koc estimado = 1,86), la utilización del ácido dipicolínico como sustrato de crecimiento por microorganismos no está limitada por la biodisponibilidad en la naturaleza.
Véase también
- Ácido dinicotínico, un ácido dicarboxílico isomérico
- El ácido 2,6-piridindicarbotioico tiene ambos grupos -COOH (ácido carboxílico) reemplazados por grupos -COSH (ácido tiocarboxílico).
Referencias
- ↑ Número CAS
- ↑ a b Setlow, Peter; Nicholson, W. L. (2014). «Spore Resistance Properties». Microbiology Spectrum 2 (5): 1274-1279. Bibcode:2001ApEnM..67.1274S. PMC 92724. PMID 11229921. doi:10.1128/microbiolspec.tbs-0003-2012.
- ↑ Rosen, D.L.; Sharpless, C.; McGown, L.B. (1997). «Bacterial Spore Detection and Determination by Use of Terbium Dipicolinate Photoluminescence». Analytical Chemistry 69 (6): 1082-1085. doi:10.1021/ac960939w.
- ↑ Barela, T.D.; Sherry, A.D. (1976). «A simple, one step fluorometric method for determination of nanomolar concentrations of terbium». Analytical Biochemistry 71 (2): 351-357. PMID 1275238. doi:10.1016/s0003-2697(76)80004-8.
- ↑ Sims, G. K.; O'Loughlin, E.J. (1989). «Degradation of pyridines in the environment». CRC Critical Reviews in Environmental Control 19 (4): 309-340. doi:10.1080/10643388909388372.
- ↑ Sims, G. K.; Sommers, L.E. (1986). «Biodegradation of pyridine derivatives in soil suspensions». Environmental Toxicology and Chemistry 5 (6): 503-509. doi:10.1002/etc.5620050601.