Tricloruro de boro
| Tricloruro de boro | ||
|---|---|---|
| General | ||
| Otros nombres |
Cloruro de boro (III) Tricloroborano | |
| Fórmula estructural |
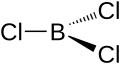 | |
| Fórmula molecular | BCl3 | |
| Identificadores | ||
| Número CAS | 10294-34-5[1] | |
| Número RTECS | ED1925000 | |
| ChemSpider | 23480 | |
| PubChem | 25135 | |
| UNII | K748471RAG | |
| Propiedades físicas | ||
| Densidad | 1326 kg/m³; 1,326 g/cm³ | |
| Masa molar | 115,91586344 g/mol | |
| Punto de fusión | −107.3 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tricloruro de boro es un compuesto inorgánico de fórmula BCl3. Este gas incoloro se utiliza como reactivo en síntesis orgánica. Es muy reactivo con el agua.
Producción y estructura
El boro reacciona con los halógenos para formar los trihaluros correspondientes. Sin embargo, el tricloruro de boro se produce industrialmente clorando óxido de boro y carbono a 501 °C.
- B2O3 + 3 C + 3 Cl2 → 2 BCl3 + 3 CO
La reacción carbotérmica es análoga al proceso Kroll para la conversión del dióxido de titanio en tetracloruro de titanio. Una consecuencia de este proceso de síntesis es que las muestras de tricloruro de boro suelen contener fosgeno. [2]
En el laboratorio, el BC 3 se puede preparar tratando el AlCl3 con BF3, una reacción de intercambio de haluro.
El BCl3 es una molécula trigonal plana, como los demás trihaluros de boro. La longitud del enlace B-Cl es de 175 pm. Se ha propuesto un grado de enlace π para explicar la corta distancia B-Cl, aunque existe cierto debate sobre su alcance. [3] El BCl3 no dimeriza, aunque los estudios de RMN de mezclas de trihaluros de boro muestran la presencia de haluros mixtos. Esta ausencia de dimerización contrasta con la tendencia de AlCl3 y GaCl3, que forman dímeros o polímeros con centros metálicos de cuatro o seis coordinaciones.
Reacciones
El BCl3 se hidroliza fácilmente para dar ácido clorhídrico y ácido bórico :
- BCl3 + 3 H2O → B(OH)3 + 3 HCl
Los alcoholes se comportan de forma análoga dando lugar a los ésteres de borato, por ejemplo, borato de trimetilo.

Como ácido de Lewis fuerte, el BCl3 forma aductos con aminas terciarias, fosfinas, éteres, tioéteres e iones de haluro.[4] La formación de aductos suele ir acompañada de un aumento de la longitud del enlace B-Cl. El compuesto BCl3•S(CH3)2 (CAS# 5523-19-3) se emplea a menudo como fuente de BCl3 convenientemente manipulado porque este sólido (p.m. 88-90 °C) libera BCl3.
- (CH3)2S·BCl3 ⇌ (CH3)2S + BCl3
También se conocen los cloruros mixtos de arilo y alquilo de boro. El dicloruro de fenilboro está disponible en el mercado. Estas especies pueden prepararse mediante la reacción de redistribución de BCl3 con reactivos organoestánnicos:
- 2 BCl3 + R4Sn → 2 RBCl2 + R2SnCl2
Reducción
La reducción de BCl3 a boro elemental se lleva a cabo comercialmente en el laboratorio cuando el tricloruro de boro puede convertirse en tetracloruro de diboro mediante calentamiento con cobre metálico. [5]
- 2 BCl3 + 2 Cu → B2Cl4 + 2 CuCl
El B4Cl4 también puede prepararse de este modo. El tetracloruro de diboro, incoloro (p.m. -93 °C), es una molécula planar en estado sólido similar al tetróxido de dinitrógeno, pero en fase gaseosa la estructura es escalonada.[3] Se descompone (desproporciona) a temperatura ambiente para dar una serie de monocloruros que tienen la fórmula general (BCl)n, en la que n puede ser 8, 9, 10 o 11.
- n B2Cl4 → BnCln + n BCl3
Se sabe que los compuestos con fórmulas B8Cl8 y B9Cl9 contienen jaulas cerradas de átomos de boro.
Usos
El tricloruro de boro es un material de partida para la producción de boro elemental. También se utiliza en el refinado de aleaciones de aluminio, magnesio, zinc y cobre para eliminar nitruros, carburos y óxidos del metal fundido. También se ha utilizado como fundente de soldadura para aleaciones de aluminio, hierro, zinc, tungsteno y monel. Las fundiciones de aluminio se pueden mejorar tratando la masa fundida con vapores de tricloruro de boro. En la fabricación de resistencias eléctricas, se puede colocar una película de carbono adhesiva uniforme y duradera sobre una base cerámica utilizando BCl3 . Se ha utilizado en el campo de los combustibles de alta energía y propulsores de cohetes como fuente de boro para elevar el valor BTU. El BCl3 también se utiliza en el grabado de plasma en la fabricación de semiconductores. Este gas graba óxidos metálicos mediante la formación de compuestos volátiles BOClx y MxOyClz .
El BCl3 se utiliza como reactivo en la síntesis de compuestos orgánicos. Al igual que el bromuro correspondiente, escinde enlaces CO en éteres . [6] [7]
Seguridad
El BCl3 es un reactivo agresivo que puede formar cloruro de hidrógeno al exponerse a la humedad o a los alcoholes. El aducto de sulfuro de dimetilo (BCl3SMe2), que es un sólido, es mucho más seguro de usar,[8] pero el H2O destruirá la parte BCl3 mientras que dejará sulfuro de dimetilo en solución.
Referencias
- ↑ Número CAS
- ↑ Brotherton, Robert J.; Weber, C. Joseph; Guibert, Clarence R.; Little, John L. (2000). «Boron Compounds». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a04_309.
- ↑ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2 edición). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Gerrard, W.; Lappert, M. F. (1958). «Reactions Of Boron Trichloride With Organic Compounds». Chemical Reviews 58 (6): 1081-1111. doi:10.1021/cr50024a003.
- ↑ Wartik, T.; Rosenberg, R.; Fox, W. B. (1967). «Diboron Tetrachloride». Inorganic Syntheses 10. pp. 118-125. ISBN 978-0-470-13241-8. doi:10.1002/9780470132418.ch18.
- ↑ Paquette, L., ed. (2004). «Boron Trichloride». Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons. ISBN 0-471-93623-5. doi:10.1002/047084289X.rb245.pub2.
- ↑ Shun Okaya; Keiichiro Okuyama; Kentaro Okano; Hidetoshi Tokuyama (2016). «Trichloroboron-promoted Deprotection of Phenolic Benzyl Ether Using Pentamethylbenzene as a Non Lewis-Basic Cation Scavenger». Org. Synth. 93: 63-74. doi:10.15227/orgsyn.093.0063.
- ↑ Williard, Paul G.; Fryhle, Craig B. (1980). «Boron trihalide-methyl sulfide complexes as convenient reagents for dealkylation of aryl ethers». Tetrahedron Letters 21 (39): 3731. doi:10.1016/0040-4039(80)80164-X.
Lectura adicional
- Martin, D. R. (1944). «Coordination Compounds of Boron Trichloride. I. - A Review». Chemical Reviews 34 (3): 461-473. doi:10.1021/cr60109a005.
- Kabalka, G. W.; Wu, Z. Z.; Ju, Y. H. (2003). «The Use of Organoboron Chlorides and Bromides in Organic Synthesis». Journal of Organometallic Chemistry 680 (1–2): 12-22. doi:10.1016/S0022-328X(03)00209-2.
Enlaces externos
- Esta obra contiene una traducción derivada de «Boron trichloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.