Cloruro de galio (III)
| Cloruro de galio | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres |
Tricloruro de galio Triclorogalio | |
| Fórmula molecular | GaCl3 | |
| Identificadores | ||
| Número CAS | 13450-90-3[1] | |
| Número RTECS | LW9100000 | |
| ChemSpider | 24229 | |
| PubChem | 26010 | |
| UNII | 4Y6GQD4915 | |
| Propiedades físicas | ||
| Densidad | 2470 kg/m³; 2,47 g/cm³ | |
| Masa molar | 173,832 g/mol | |
| Punto de fusión | 77,9 °C (351 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de galio (III) es un compuesto químico inorgánico de fórmula GaCl3 que forma un monohidrato, GaCl3·H₂O. El cloruro de galio (III) sólido es un cristal incoloro y delicuescente que existe como dímero con la fórmula Ga2Cl6.[2] Es incoloro y soluble en prácticamente todos los disolventes, incluso en alcanos, lo que es inusual para un haluro metálico. Es el principal precursor de la mayoría de los derivados del galio y un reactivo en síntesis orgánica.[3]
Como ácido de Lewis, GaCl
3 es más suave que el cloruro de aluminio. También es más fácil de reducir que el cloruro de aluminio. La química de coordinación de Ga (III) y Fe (III) es similar, por lo que el cloruro de galio (III) se ha utilizado como un análogo diamagnético del cloruro férrico.
Preparación
El cloruro de galio (III) puede prepararse a partir de los elementos calentando galio metálico en una corriente de cloro a 200 °C y purificando el producto por sublimación al vacío.[4][5]
- 2 Ga + 3 Cl
2 → 2 GaCl
3
También se puede preparar calentando óxido de galio con cloruro de tionilo : [6]
- Ga
2O
3 + 3 SOCl
2 → 2 GaCl
3 + 3 SO
2
El metal galio reacciona lentamente con el ácido clorhídrico, produciendo gas hidrógeno.[7] La evaporación de esta solución produce el monohidrato.[8]
Estructura
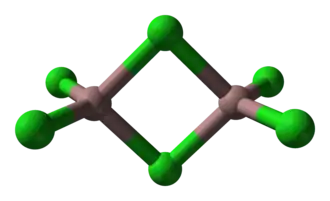
Como sólido, adopta una estructura bitetraédrica con dos cloruros puente. Su estructura se parece a la del tribromuro de aluminio. En cambio, AlCl3 e InCl3 presentan seis centros metálicos coordinados. Debido a su naturaleza molecular y a la baja energía de red asociada, el cloruro de galio (III) tiene un punto de fusión más bajo que los haluros de aluminio e indio (III). La fórmula del Ga2Cl6 se escribe a menudo como Ga2(μ-Cl)2Cl4.[9]
En la fase gaseosa, las formas dimérica (Ga2Cl6) y monomérica trigonal plana (GaCl3) están en equilibrio, y a temperaturas más altas tiende a predominar la forma monomérica. A 870 K, todas las moléculas en fase gaseosa se encuentran efectivamente en forma monomérica.[10]
En el monohidrato, el galio está coordinado tetraédricamente con tres moléculas de cloro y una molécula de agua.[8]
Propiedades
Físicas
El cloruro de galio (III) es un sólido incoloro, diamagnético y delicuescente que funde a 77,9 °C y hierve a 201 °C sin descomponerse en los elementos que lo componen. Este bajo punto de fusión se debe a que forma moléculas discretas de GaCl6 en estado sólido. El cloruro de galio (III) se disuelve en agua con desprendimiento de calor para formar una solución incolora que, al evaporarse, produce un monohidrato incoloro que funde a 44,4 °C.[8][11][12]
Químicas
El galio es el miembro más ligero del Grupo 13 que tiene una capa electrónica d completa (el galio tiene la configuración electrónica [Ar] 3d10 4s2 4p1) por debajo de los electrones de valencia que podrían participar en enlaces π de capa electrónica d con ligandos. El bajo estado de oxidación del Ga en el Ga (III) Cl3, junto con la baja electronegatividad y la alta polarizabilidad, permiten que el GaCl3 se comporte como un «ácido blando» en términos de la teoría HSAB.[13] La fuerza de los enlaces entre los haluros de galio y los ligandos se ha estudiado ampliamente. Lo que se desprende de ello es lo siguiente:
- El GaCl3 es un ácido de Lewis más débil que el AlCl3 frente a los donantes N y O, por ejemplo, la piridina.
- Sin embargo, el GaCl3 es un ácido de Lewis más fuerte que el AlCl3 frente a los tioéteres, como el sulfuro de dimetilo (CH
3)
2S.
Con el ion cloruro como ligando se produce el ion tetraédrico tetraclorogalato (III) [GaCl
4]−
pero no se puede fabricar el de seis coordenadas [GaCl
6]3−. Se conocen compuestos como K[Ga2Cl7] que tienen un anión cloruro puenteado.[14] En una mezcla fundida de KCl y GaCl3 existe el siguiente equilibrio:
- 2 [GaCl
4]−
⇌ [Ga
2Cl
7]−
+ Cl−
Cuando se disuelve en agua, el cloruro de galio (III) se disocia en los iones octaédricos [Ga(H
2O)
6]3+ y Cl−
, formando una solución ácida debido a la hidrólisis del ion hexaaquogalio (III).[15]
- [Ga(H
2O)
6]3+ → [Ga(H
2O)
5OH]2+ + H+
(pKa = 3.0)
En solución básica, se hidroliza a hidróxido de galio (III), que se redisuelve con la adición de más hidróxido, posiblemente para formar [Ga(OH)
4]−
.[15]
Usos
Síntesis orgánica
El cloruro de galio (III) es un catalizador de ácido de Lewis, como en la reacción de Friedel-Crafts, capaz de sustituir a ácidos de Lewis más comunes como el cloruro férrico. El galio forma complejos fuertemente con los donantes π, especialmente los sililetinos, produciendo un complejo fuertemente electrofílico. Estos complejos se utilizan como agente alquilante para hidrocarburos aromáticos.[3]
También se utiliza en reacciones de carbogalación de compuestos con un triple enlace carbono-carbono. También se utiliza como catalizador en muchas reacciones orgánicas.[3]
Compuestos de organogalio
Es un precursor de los reactivos de organogalio. Por ejemplo, el trimetilgalio, un compuesto de organogalio utilizado en MOCVD para producir varios semiconductores que contienen galio, se produce mediante la reacción del cloruro de galio (III) con varios agentes alquilantes, como el dimetilzinc, trimetilaluminio o yoduro de metilmagnesio.[16][17]
Purificación del galio
El cloruro de galio (III) es un producto intermedio en varios procesos de purificación del galio, en los que se destila fraccionadamente o se extrae de soluciones ácidas.[7]
Detección de neutrinos solares
En los experimentos GALLEX y GNO, realizados en los Laboratori Nazionali del Gran Sasso (Italia) para detectar neutrinos solares, se utilizaron 110 toneladas de solución acuosa de cloruro de galio (III). En estos experimentos, el germanio-71 se produjo mediante interacciones de neutrinos con el isótopo galio-71 (que tiene una abundancia natural del 40 %), y se midieron las posteriores desintegraciones beta del germanio-71.[11]
Referencias
- ↑ Número CAS
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ a b c Yamaguchi, Masahiko; Matsunaga, Shigeki; Shibasaki, Masakatsu; Michelet, Bastien; Bour, Christophe; Gandon, Vincent (2014), Gallium Trichloride, John Wiley & Sons, Ltd, pp. 1-8, ISBN 9780470842898, doi:10.1002/047084289x.rn00118u.pub3.
- ↑ Roger A. Kovar; J. A. Dilts (1977). «Gallium Trichloride». Inorganic Syntheses Volume 17 (en inglés). McGraw‐Hill. pp. 167-172. ISBN 9780470131794.
- ↑ «Gallium and Gallium Compounds». Kirk-Othmer Encyclopedia of Chemical Technology (en inglés). 2013. ISBN 9780471238966. doi:10.1002/0471238961.0701121219010215.a01.pub3.
- ↑ H. Hecht; G. Jander; H. Schlapmann (1947). «Über die Einwirkung von Thionylchlorid auf Oxyde» [On the effect of thionyl chloride on oxides]. Zeitschrift für anorganische Chemie (en inglés) 254 (5-6): 255-264. doi:10.1002/zaac.19472540501.
- ↑ a b «Gallium and Gallium Compounds». Ullmann's Encyclopedia of Industrial Chemistry (en inglés). 2000. ISBN 9783527306732. doi:10.1002/14356007.a12_163.
- ↑ a b c Jacques Roziere; Marie-Thérèse Roziere-Bories; Alain Manteghetti; Antoine Potier (1974). «Hydrates des halogenures de gallium. II Spectroscopie de vibration des complexes coordinés GaX3•H2O (X = Cl ou Br)». Canadian Journal of Chemistry (en francés) 52 (18): 3274-3280. doi:10.1139/v74-483.
- ↑ Sergey I. Troyanov; Thoralf Krahl; Erhard Kemnitz (2004). «Crystal structures of GaX3 (X = Cl, Br, I) and AlI3». Zeitschrift für Kristallographie - Crystalline Materials (en inglés) 219 (2): 88-92. doi:10.1524/zkri.219.2.88.26320.
- ↑ Viacheslav I. Tsirelnikov; Boris V. Lokshin; Petr Melnikov; Valter A. Nascimento (2012). «On the Existence of the Trimer of Gallium Trichloride in the Gaseous Phase». Zeitschrift für anorganische und allgemeine Chemie (en inglés) 638 (14): 2335-2339. doi:10.1002/zaac.201200282.
- ↑ a b David R. Lide, ed. Handbook of Chemistry and Physics, 85th Edition, Internet Version 2005. CRC Press, 2005.
- ↑ J. Burgess; J. Kijowski (1981). «Enthalpies of solution of chlorides and iodides of gallium(III), indium(III), thorium(IV) and uranium(IV)». Journal of Inorganic and Nuclear Chemistry (en inglés) 43 (11): 2649-2652. doi:10.1016/0022-1902(81)80592-1.
- ↑ Housecroft, Catherine E.; Sharpe, Alan G. (2018). Inorganic Chemistry (5th edición). Harlow, Essex: Pearson Education. ISBN 978-1-292-13414-7.
- ↑ Jens H. Von Barner (1985). «Potentiometric and Raman spectroscopic study of the complex formation of gallium(III) in potassium chloride-aluminum chloride melts at 300C». Inorganic Chemistry (en inglés) 24 (11): 1686-1689. doi:10.1021/ic00205a019.
- ↑ a b Scott A. Wood; Iain M. Samson (2006). «The aqueous geochemistry of gallium, germanium, indium and scandium». Ore Geology Reviews (en inglés) 28 (1): 57-102. doi:10.1016/j.oregeorev.2003.06.002.
- ↑ Kraus, C. A.; Toonder, F. E. (1933). «Trimethyl Gallium, Trimethyl Gallium Etherate and Trimethyl Gallium Ammine». PNAS 19 (3): 292-8. Bibcode:1933PNAS...19..292K. PMC 1085965. PMID 16577510. doi:10.1073/pnas.19.3.292.
- ↑ Foster, Douglas F.; Cole-Hamilton, David J. (1997). «Electronic Grade Alkyls of Group 12 and 13 Elements». Inorganic Syntheses 31. pp. 29-66. ISBN 978-0-471-15288-0. doi:10.1002/9780470132623.ch7.
Enlaces externos
- «Emergency First Aid Treatment Guide - Gallium Trichloride». United States Environmental Protection Agency. Archivado desde el original el 12 de noviembre de 2004.
- Esta obra contiene una traducción derivada de «Gallium(III) chloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.