Tribromuro de boro
| Tribromuro de boro | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres |
Tribromoborano Bromuro de boro | |
| Fórmula estructural |
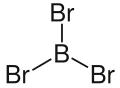 | |
| Fórmula molecular | BBr3 | |
| Identificadores | ||
| Número CAS | 10294-33-4[1] | |
| Número RTECS | ED7400000 | |
| ChemSpider | 23479 | |
| PubChem | 25134 | |
| UNII | A453DV9339 | |
| Propiedades físicas | ||
| Densidad | 2643 kg/m³; 2,643 g/cm³ | |
| Masa molar | 247,7643167 g/mol | |
| Punto de fusión | - 46,3 °C (319 K) | |
| Índice de refracción (nD) | 1,312 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tribromuro de boro, BBr3, es un compuesto líquido incoloro y fumante que contiene boro y bromo. Las muestras comerciales suelen ser de color ámbar a rojo marrón debido a una pequeña contaminación por bromo. Se descompone con el agua y los alcoholes.[2]
Propiedades químicas
El tribromuro de boro está disponible comercialmente y es un ácido de Lewis fuerte.
Es un excelente agente desmetilante o desalquilante para la escisión de éteres, también con posterior ciclización, a menudo en la producción de productos farmacéuticos.[3]
El mecanismo de desalquilación de los éteres alquílicos terciarios consiste en la formación de un complejo entre el centro de boro y el oxígeno del éter, seguido de la eliminación de un bromuro de alquilo para producir un dibromo(organo)borano.
- ROR + BBr3 → RO+ ( −BBr3)R → ROBBr2 + RBr
Por otra parte, los éteres de metilo arílicos (así como los éteres de alquilo primarios activados) se desalquilan a través de un mecanismo bimolecular que involucra dos aductos de BBr3-éter. [4]
- RO+(−BBr3)CH3 + RO+(−BBr3)CH3 → RO(−BBr3) + CH3Br + RO+(BBr2)CH3
El dibromo(organo)borano puede luego sufrir hidrólisis para dar un grupo hidroxilo, ácido bórico y bromuro de hidrógeno como productos. [5]
- ROBBr2 + 3H2O → ROH + B(OH)3 + 2HBr
También encuentra aplicaciones en la polimerización de olefinas y en la química de Friedel-Crafts como catalizador ácido de Lewis.
La industria electrónica utiliza tribromuro de boro como fuente de boro en procesos de predeposición para dopaje en la fabricación de semiconductores.[6] El tribromuro de boro también media la desalquilación de éteres de arilo alquilo, por ejemplo, la desmetilación del 3,4-dimetoxiestireno en 3,4-dihidroxiestireno .
Síntesis
La reacción del carburo de boro con el bromo a más de 300 °C da lugar a tribromuro de boro. Este producto puede purificarse mediante destilación al vacío.
Historia
La primera síntesis la realizó Poggiale en 1846 al hacer reaccionar trióxido de boro con carbono y bromo a altas temperaturas. [7]
- B2O3 + 3 C + 3 Br2 → 2 BBr3 + 3 CO
En 1857, F. Wöhler y Deville perfeccionaron este método. Al partir de boro amorfo, las temperaturas de reacción son más bajas y no se produce monóxido de carbono. [8]
- 2 B + 3 Br2 → 2 BBr3
Aplicaciones
El tribromuro de boro se utiliza en la síntesis orgánica,[9] la fabricación farmacéutica, el procesamiento de imágenes, el dopaje de semiconductores, el grabado por plasma de semiconductores y la fabricación fotovoltaica.
Referencias
- ↑ Número CAS
- ↑ «Boron Tribromide». Toxicologic Review of Selected Chemicals. National Institute for Occupational Safety and Health. 21 de septiembre de 2018.
- ↑ Doyagüez, E. G. (2005). «Boron Tribromide». Synlett 2005 (10): 1636-1637. doi:10.1055/s-2005-868513.
- ↑ Sousa, C.; Silva, P.J. (2013). «BBr3-Assisted Cleavage of Most Ethers Does Not Follow the Commonly Assumed Mechanism». Eur. J. Org. Chem. 2013 (23): 5195-5199. doi:10.1002/ejoc.201300337.
- ↑ McOmie, J. F. W.; Watts, M. L.; West, D. E. (1968). «Demethylation of Aryl Methyl Ethers by Boron Tribromide». Tetrahedron 24 (5): 2289-2292. doi:10.1016/0040-4020(68)88130-X.
- ↑ Komatsu, Y.; Mihailetchi, V. D.; Geerligs, L. J.; van Dijk, B.; Rem, J. B.; Harris, M. (2009). «Homogeneous p+ emitter diffused using borontribromide for record 16.4% screen-printed large area n-type mc-Si solar cell». Solar Energy Materials and Solar Cells 93 (6–7): 750-752. doi:10.1016/j.solmat.2008.09.019.
- ↑ Poggiale, M. (1846). «Nouveau composé de brome et de bore, ou acide bromoborique et bromoborate d'ammoniaque». Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences 22: 124-130.
- ↑ Wöhler, F.; Deville, H. E. S.-C. (1858). «Du Bore». Annales de Chimie et de Physique 52: 63-92.
- ↑ Akira Suzuki, Shoji Hara, Xianhai Huang (2006). Boron Tribromide. «Encyclopedia of Reagents for Organic Synthesis». E-EROS Encyclopedia of Reagents for Organic Synthesis. ISBN 978-0471936237. doi:10.1002/047084289X.rb244.pub2.
Lectura adicional
- Doyagüez, E. G. (2005). «Boron Tribromide». Synlett 2005 (10): 1636-1637. doi:10.1055/s-2005-868513.
Enlaces externos
- Tribromuro de boro en len The Periodic Table of Videos (Universidad de Nottingham)
- Guía de bolsillo del NIOSH sobre riesgos químicos: tribromuro de boro (Centros para el Control y la Prevención de Enfermedades)
- Esta obra contiene una traducción derivada de «Boron tribromide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.