Bromuro de hidrógeno
| Bromuro de hidrógeno | ||
|---|---|---|
 | ||
| General | ||
| Fórmula estructural |
| |
| Fórmula molecular | HBr | |
| Identificadores | ||
| Número CAS | 10035-10-6[1] | |
| Número RTECS | MW3850000 | |
| ChEBI | 47266 | |
| ChEMBL | CHEMBL1231461 | |
| ChemSpider | 255 | |
| PubChem | 22169024 260, 22169024 | |
| UNII | 3IY7CNP8XJ | |
| KEGG | C13645 | |
|
Br
| ||
| Propiedades físicas | ||
| Olor | Acre | |
| Densidad | 3,307 kg/m³; 0,003307 g/cm³ | |
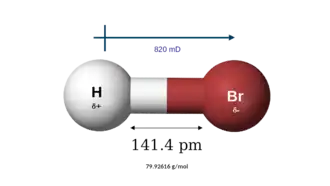
| Masa molar | 80,92 g/mol | |
| Punto de fusión | −86,9 °C (186 K) | |
| Punto de ebullición | −66,8 °C (206 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | 1930 g/L (20 °C) | |
| Solubilidad | Soluble en alcohol y otros disolventes orgánicos | |
| Peligrosidad | ||
| SGA |
 , , , , | |
| NFPA 704 |
0
3
0
COR
| |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bromuro de hidrógeno es un compuesto inorgánico de fórmula HBr. Es un haluro de hidrógeno compuesto de hidrógeno y bromo. En condiciones normales de presión y temperatura, es un gas incoloro soluble en agua, alcanzando la saturación con un 68,85% de HBr en peso, a temperatura ambiente. La disolución acuosa formada recibe en nombre común de ácido bromhídrico. Las soluciones acuosas que contienen 47,6 % de HBr en masa forman una mezcla azeotrópica de punto de ebullición constante que hierve a 124,3 grados Celsius (255,7 °F). Al hervir soluciones menos concentradas se libera H2O hasta que se alcanza la composición de la mezcla de ebullición constante.
Reacciones
El bromuro de hidrógeno y el ácido bromhídrico son reactivos de uso frecuente en la preparación de compuestos organobromados . En una reacción de adición electrofílica, el HBr se agrega a los alquenos:[2]
Los bromuros de alquilo resultantes son agentes alquilantes útiles, por ejemplo, como precursores de derivados de aminas grasas . Las adiciones de radicales libres relacionadas con el cloruro de alilo y el estireno dan 1-bromo-3-cloropropano y bromuro de feniletilo, respectivamente.
El bromuro de hidrógeno reacciona con diclorometano para dar bromoclorometano, que en exceso de reactivo, continua la reacción produciendo el derivado dibromado (dibromometano):
El bromuro de alilo se prepara tratando el alcohol alílico con HBr:
El HBr se añade a los alquinos para producir bromoalquenos. La estereoquímica de este tipo de adición suele ser anti:
Además, el HBr agrega epóxidos y lactonas, lo que da como resultado la apertura del anillo.
Con trifenilfosfina, HBr reacciona produciendo bromuro de trifenilfosfonio, una "fuente" sólida de HBr.
Química inorgánica
El bromuro de vanadio(III) y el bromuro de molibdeno(IV) se preparan mediante reducción con HBr de los correspondientes cloruros metálicos en un estado de oxidación superior: [3]
Preparación industrial
El bromuro de hidrógeno (junto con el ácido bromhídrico) se produce por reacción entre hidrógeno y bromo a temperaturas entre 200 y 400 °C. La reacción suele estar catalizada por platino o amianto. [4][2]
Síntesis de laboratorio
El HBr se puede preparar mediante reacción y posterior destilación de una solución de bromuro de sodio o bromuro de potasio con ácido fosfórico o ácido sulfúrico:[5]
El empleo de ácido sulfúrico concentrado es menos eficaz porque oxida el HBr a bromo:
El bromuro de hidrógeno anhidro también se puede obtener a pequeña escala mediante termólisis del bromuro de trifenilfosfonio en xileno por calentamiento a reflujo.[6]
El bromuro de hidrógeno preparado mediante los métodos anteriores puede estar contaminado con bromo molecular (Br2), que se puede eliminar haciendo pasar el gas a través de una solución de fenol a temperatura ambiente en tetracloruro de carbono u otro disolvente adecuado (lo que produce 2,4,6-tribromofenol y genera más HBr en el proceso) o a través de virutas de cobre o gasa de cobre a alta temperatura.[4]
Seguridad
El HBr es altamente corrosivo y, si se inhala, puede causar daño pulmonar. [7]
Véase también
Referencias
- ↑ Número CAS
- ↑ a b Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (en inglés). Oxford (UK): Butterworth-Heinemann. pp. 809-812. ISBN 0-7506-3365-4.
- ↑ Calderazzo, Fausto; Maichle-Mössmer, Cäcilie; Pampaloni, Guido; Strähle, Joachim (1993). «Low-Temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange». J. Chem. Soc., Dalton Trans. (5): 655-658. doi:10.1039/DT9930000655.
- ↑ a b John R. Ruhoff, Robert E. Burnett, and E. Emmet Reid. Checked by W. H. Carothers and W. L. McEwen. (1935). «HYDROGEN BROMIDE (ANHYDROUS)». Organic Syntheses (en inglés) 15: 35. doi:10.15227/orgsyn.015.0035. Consultado el 11 de diciembre de 2024.
- ↑ Schmeisser, M. (1963). «Chlorine, Bromine, Iodine». Handbook of Preparative Inorganic Chemistry, 2nd Ed. (en inglés). Nueva York: Academic Press.
- ↑ Hercouet, A.; Le Corre, M. (1988). «Triphenylphosphonium Bromide: A Convenient and Quantitative Source of Gaseous Hydrogen Bromide». Synthesis (en inglés) 1988 (02): 157-158. ISSN 0039-7881. doi:10.1055/s-1988-27502. Consultado el 11 de diciembre de 2024.
- ↑ «Hydrobromic Acid». PubChem. Springer Nature. 3 de febrero de 2024. Consultado el 9 de febrero de 2024.
