Epóxido
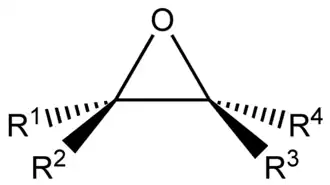
Los epóxidos son un grupo de compuestos orgánicos caracterizados por ser éteres cíclicos formados por un átomo de oxígeno unido a dos átomos de carbono, que a su vez están unidos entre sí mediante un solo enlace covalente, dando lugar a una estructura cíclica muy rígida y tensa, que hace que sean mucho más reactivos que la mayoría de los éteres. Por ello, los epóxidos son útiles en la síntesis de polímeros, productos farmacéuticos y química fina. Entre los epóxidos más comunes se encuentran dos productos químicos básicos, el óxido de propileno y el óxido de etileno, con numerosas aplicaciones en síntesis orgánica.[1] Los epóxidos son generalmente líquidos, incoloros, solubles en alcohol, éter y benceno.[2]
Nomenclatura
Los epóxidos simples se nombran a partir del compuesto "parental", que es el óxido de etileno u oxirano, tal y como ocurre con el clorometiloxirano. También reciben el nombre de óxido, como por ejemplo, óxido de etileno (oxirano), óxido de ciclohexeno. Otros epóxidos tienen nombres triviales, como el glicidol (2,3- epoxi-1-propanol) o el ya mencionado oxirano. Los de cadena más larga, se nombran anteponiendo el prefijo «epoxi-» al hidrocarburo de igual número de átomos de carbono e indicando los carbonos que están unidos al oxígeno con números separados por comas y a la vez, estos separados por un guion de sufijo, como por ejemplo, 2,3-epoxihexano. Algunos nombres enfatizan la presencia del grupo funcional epóxido, como en el caso del compuesto 1,2-epoxiheptano, que también puede denominarse óxido de 1,2-hepteno.
Síntesis
La principal vía de preparación de epóxidos es la oxidación del alqueno correspondiente, dada la relativa facilidad con que el oxígeno se une al doble enlace. Pueden utilizarse diversos agentes oxidantes, dependiendo de la naturaleza de lo productos deseados. Peróxidos orgánicos y peroxiácidos suelen ser agentes oxidantes adecuados, ya que rompen el enlace π del doble enlace, formándose el correspondiente éter cíclico. El peroxiácido reacciona con el alqueno mediante una reacción electrofílica concertada en la que los enlaces se forman y se rompen al mismo tiempo, sin necesidad del empleo de catacalizadores. La reacción entre la olefina y el peroxiácido tiene lugar mediante un único paso mecanístico y los productos del proceso son el epóxido y el ácido carboxílico correspondiente.[3] Los peroxiácidos más utilizados son el ácido peroxibenzoico (C6H5CO3H), el monoperoxiftálico (o-HOOC-C6H4-CO3H) y el peroxiacético (CH3CO3H).[4] Las operaciones típicas de laboratorio emplean la reacción de Prileschajew.[5] Un ejemplo ilustrativo es la epoxidación del estireno con ácido peroxibenzoico a óxido de estireno:
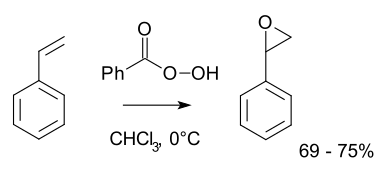
Dado que los peroxiácidos orgánicos son especies electrófilas, la velocidad de reacción con los alquenos se hace mayor en presencia de sustituyentes que ceden electrones, como pueden ser los radicales alquilo. Aquellos alquenos con tres o cuatro sustituyentes alquilo son rápidamente oxidados, formando el correspondiente epóxido, mientras que los alqueno terminales (R-CH=CH2) reaccionan de forma mucho más lenta. Otra característica de las formación de epóxidos a partir de alquenos y peroxiácidos, es que se trata de una reacción estereoespecífica, ya que se produce preferentemente con el isómero cis.[4]
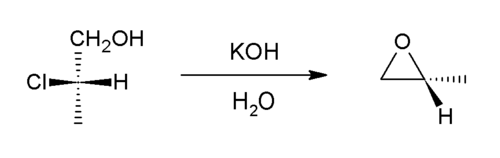
Otra forma de preparación de epóxidos a partir de un alqueno es a través de la formación de una halohidrina . En este caso, la formación del epóxido se produce en dos pasos; en una primera reacción el alqueno reacciona con ácido hipocloroso o ácido hipobromoso, en los que el halógeno y el grupo hidroxilo del ácido se unen a cada uno de los carbonos adyacentes de grupo olefínico, formando la correspondiente halohidrina. Cuando la halohidrina se trata con una base se produce una reacción SN2 intramolecular que da lugar a un epóxido. Este procedimiento resulta relativamente económico y es el habitualmente utilizado en la producción industrial del óxido de propileno (epoxipropano) a partir del propileno.[6]
El óxido de propileno es ampliamente utilizado como reactivo de partida en la producción de poliuretano. El epóxido se convierte en un poliol y luego, reacciona con isocianatos para formar el poliuretano. También se convierte en polipropilenglicol mediante una polimerización de apertura de anillos.
Otro epóxido de gran interés para la industria es el óxido de etileno u oxirano, utilizado en la síntesis del etilenglicol (una sustancia química usada como anticongelante y en la producción de polímeros, como poliéster y el tereftalato de polietileno). También, el gas de óxido de etileno se usa en aplicaciones médicas como agente esterilizador de instrumentos quirúrgicos. Para su producción a gran escala puede mediante el proceso de hidrocloración (formación de la clorhidrina), ya en desuso o, más recientemente, haciendo reaccionar el oxígeno con el propileno a temperatura y presión elevadas en presencia de un catalizador de plata.[7]
Solo el etileno produce un epóxido durante la combustión incompleta. Otros alquenos no reaccionan de forma eficaz, ni siquiera el propileno, aunque se ha realizado estudios para oxidar selectivamente este alqueno utilizando catalizadores de Au en soportes de titanio-silicio. [8]
Reactividad
Los epóxidos son mucho más reactivos que los éteres debido a la rigidez de su estructura. Debido a la tensión existente en el anillo reaccionan fácilmente con los ácidos y con muchas bases. La mayoría de las reacciones en las que intervienen los epóxidos implican la apertura del anillo y son la base de múltiples reacciones de síntesis orgánica.[9]
Adición de nucleófilos
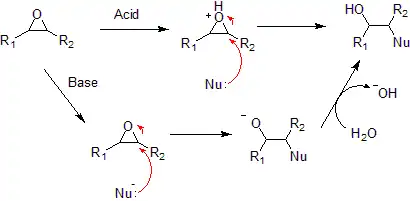
Los epóxidos reaccionan con una amplia gama de nucleófilos, como alcoholes, agua, aminas, tioles e incluso haluros. La regioselectividad por apertura de anillo en epóxidos asimétricos generalmente sigue el patrón del mecanismo SN2 en el carbono menos sustituido al ser el menos impedido, aunque puede verse afectada por la estabilidad del carbocatión en condiciones ácidas. Este tipo de reacciones es la base de los adhesivos epóxicos y la producción de glicoles.[10]
Los epóxidos reaccionan con H2O en medio ácido para formar glicoles (dioles con los grupos -OH en carbonos vecinales)que presentan estereoquímica anti. El mecanismo del proceso supone la protonación del oxígeno del anillo epoxídico seguida de un ataque nucleofílico de la molécula de agua. Si la reacción anterior se lleva a cabo en un alcohol, el nucleófilo que provoca la apertura del epóxido protonado es el propio alcohol y el producto de la reacción contiene una función éter.[3]
Tanto el hidruro de litio y aluminio como el hidruro de aluminio reducen los epóxidos mediante una simple adición nucleofílica de hidruro (H−); produciendo el alcohol correspondiente.[11]
Véase también
- Óxido de etileno
- Óxido de propileno
- Halohidrina
- Peroxiácido orgánico
Referencias
- ↑ Mettler Toledo. «Epóxidos. Grupos funcionales clave para la síntesis de polímeros y productos farmacéuticos». www.mt.com. Consultado el 25 de abril de 2025.
- ↑ Wiley-VCH, ed. (11 de marzo de 2003). Ullmann's Encyclopedia of Industrial Chemistry (en inglés) (1 edición). Wiley. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a09_531. Consultado el 26 de abril de 2025.
- ↑ a b Universidad Jaume I. «Éteres y epóxidos.». Consultado el 29 de abril de 2025.
- ↑ a b Allinger, Norman L. et al. (1975). «Cap. 15.10 Formación de epóxidos, hidroxilación y ozonolisis». Química Orgánica. Barcelona: Reverté. ISBN 84-291-7031-1.
- ↑ Prileschajew, Nikolaus (1909-11). «Oxydation ungesättigter Verbindungen mittels organischer Superoxyde». Berichte der deutschen chemischen Gesellschaft (en inglés) 42 (4): 4811-4815. ISSN 0365-9496. doi:10.1002/cber.190904204100. Consultado el 29 de abril de 2025.
- ↑ Kahlich, Dietmar; Wiechern, Uwe; Lindner, Jörg (15 de junio de 2000). Wiley-VCH Verlag GmbH & Co. KGaA, ed. Propylene Oxide (en inglés). Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a22_239. Consultado el 29 de abril de 2025.
- ↑ Sajkowski, D. J.; Boudart, M. (1987). «Structure Sensitivity of the Catalytic Oxidation of Ethene by Silver». Catalysis Reviews 29 (4): 325-360. doi:10.1080/01614948708078611.
- ↑ Nijhuis, T. Alexander; Makkee, Michiel; Moulijn, Jacob A.; Weckhuysen, Bert M. (1 de mayo de 2006). «The Production of Propene Oxide: Catalytic Processes and Recent Developments». Industrial & Engineering Chemistry Research 45 (10): 3447-3459. ISSN 0888-5885. doi:10.1021/ie0513090. Consultado el 30 de abril de 2025.
- ↑ Allinger, Norman L. et al. (1975). «Cap. 18.9. Reacciones de los epóxidos». Química Orgánica. Barcelona: Reverté. ISBN 84-291-7031-1.
- ↑ Wiley-VCH, ed. (11 de marzo de 2003). Ullmann's Encyclopedia of Industrial Chemistry (en inglés) (1 edición). Wiley. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a09_547.pub2. Consultado el 1 de mayo de 2025.
- ↑ Rickborn, Bruce; Lamke, Wallace E. (1967-03). «Reduction of epoxides. II. The lithium aluminum hydride and mixed hydride reduction of 3-methylcyclohexene oxide». The Journal of Organic Chemistry (en inglés) 32 (3): 537-539. ISSN 0022-3263. doi:10.1021/jo01278a005. Consultado el 1 de mayo de 2025.