Borabenceno
| Borabenceno | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Borinina | ||
| General | ||
| Fórmula molecular | C5H5B | |
| Identificadores | ||
| Número CAS | 31029-61-5[1] | |
| ChemSpider | 9074474 | |
| PubChem | 10899214 | |
|
B1=CC=CC=C1
| ||
| Propiedades físicas | ||
| Masa molar | 75,9 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
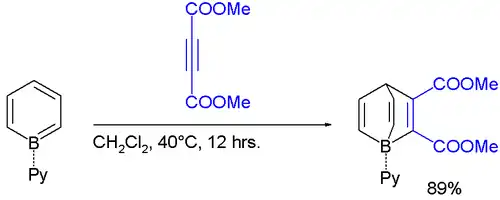
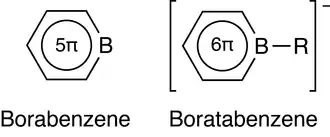
El borabenceno es un compuesto de organoboro hipotético con la fórmula C5H5B en la que un átomo de carbono del benceno es sustituido por un átomo de boro. Un compuesto de este tipo, sin ningún ligando unido al átomo de boro, aún no ha sido aislado, aunque la estructura es simple y el enlace boro-carbono es bastante robusto. Los cálculos teóricos sobre el borabenceno indican que la geometría del anillo es plana y los 5 electrones π están deslocalizados, por lo que el compuesto puede considerarse aromático.[2] Sin embargo, la estabilidad del anillo aromático se reduce en comparación con la del benceno, que tiene 6 electrones π. Además, la deficiencia de electrones del átomo de boro hace que el borabenceno sea un ácido de Lewis fuerte y muy reactivo.[2] Por estas razones, el borabenceno sólo existe si se estabiliza con bases de Lewis: si la base utilizada es neutra, obtenemos un aducto, si es negativa, obtenemos una sal de boratabenceno.
Aductos

Los aductos de borabenceno con bases de Lewis son aislables. Estos compuestos se derivan formalmente de la adición de una base de Lewis neutra (L) al borabenceno, produciendo aductos de tipo C5H5B–L. El primer compuesto de este tipo se obtuvo con piridina en 1985.[3] También se han aislado otros aductos, por ejemplo, donde L = N2,[4] 4-fenilpiridina[5] o trimetilfosfina.[6]
Como el borabenceno no está disponible comercialmente, estos aductos requieren métodos indirectos. El 4-silil-1-metoxiboraciclohexadieno se utiliza como precursor del borabenceno:
- C
5H
5N + MeOBC
5H
5SiMe
3 → C
5H
5N-BC
5H
5 + MeOSiMe3
El aducto de piridina C
5H
5N-BC
5H
5 está estructuralmente relacionado con el bifenilo.[3] Es de color amarillo, mientras que el bifenilo es incoloro, lo que indica estructuras electrónicas distintas. El ligando de piridina está fuertemente unido: no se observa intercambio con piridina libre, incluso a temperaturas elevadas.
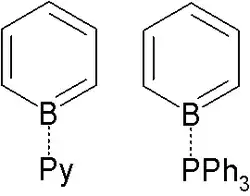
Aductos de borabenceno con piridina y trifenilfosfina.
El aducto de borabenceno-piridina se comporta como un dieno, no como un análogo del bifenilo, y experimentará reacciones de Diels-Alder.[7]
Sales de boratabenceno
La interacción del borabenceno con una base de Lewis negativa R– conduce a la especie aniónica [C5H5B–R]– llamada boratabenceno. Esta especie está estabilizada por el hecho de que el anillo aromático ahora contiene 6 electrones π y se ha satisfecho la deficiencia de electrones del boro. El anión más simple es el que tiene R = H, es decir, 1-H-boratabenceno, una especie isoelectrónica con el benceno.[8] Otros ejemplos bien conocidos son aquellos con R = Me, Ph y NMe2; Todos estos aniones se pueden precipitar con cationes adecuados (normalmente Li+).[9][10]
Véase también
- Anillos aromáticos de 6 miembros con un carbono reemplazado por otro grupo: silabenceno, germabenceno, estannabenceno, piridina, fosforina, arsabenceno, estibabenceno, bismabenceno, pirilio, tiopirilio, selenopirilio, teluropirilio
- Borazina
Referencias
- ↑ Número CAS
- ↑ a b Cioslowski, J.; Hay, P. J. (1990). «Electronic structure of borabenzene and its adducts with carbon monoxide and nitrogen». J. Am. Chem. Soc. 112 (5): 1707-1710. doi:10.1021/ja00161a009.
- ↑ a b Boese, Roland; Finke, Norbert; Henkelmann, Jochem; Maier, Günther; Paetzold, Peter; Reisenauer, Hans Peter; Schmid, Günter (1985). «Synthese und Strukturuntersuchung von Pyridin-Borabenzol und Pyridin-2-Boranaphthalin». Chemische Berichte 118 (4): 1644-1654. doi:10.1002/cber.19851180431.
- ↑ Maier, G.; Reisenauer, H. P.; Henkelmann, J.; Kliche, C. (1988). «Nitrogen Fixation by Borabenzene». Angew. Chem. 27 (2): 295-296. doi:10.1002/anie.198802951.
- ↑ Qiao, S.; Hoic, D. A.; Fu, G. F. (1997). «Synthesis and Structure of Borabenzene−4-Phenylpyridine, a Heterocyclic Analogue of p-Terphenyl». Organometallics 16 (7): 1501-1502. doi:10.1021/om9608869.
- ↑ Hoic, D. A.; Wolf, J. Robbins; Davis, W. M.; Fu, G. C. (1996). «Chemistry of Borabenzene: Efficient and General Synthesis of New Neutral Borabenzene−Ligand Complexes». Organometallics 15 (4): 1315-1318. doi:10.1021/om9505569.
- ↑ Wood, Thomas K.; Piers, Warren E.; Keay, Brian A.; Parvez, Masood (2006). «1-Borabarrelene Derivatives via Diels−Alder Additions to Borabenzenes». Organic Letters 8 (13): 2875-2878. PMID 16774279. doi:10.1021/ol061201w.
- ↑ Hoic, D. A.; Davis, W. M.; Fu, G. C. (1995). «Boron Analog of Benzene: Synthesis, Structure, and Reactivity of 1-H-Boratabenze». J. Am. Chem. Soc. 117 (32): 8480-8481. doi:10.1021/ja00137a030.
- ↑ Herberich, G. E.; Schmidt, B.; Englert, U. (1995). «Borabenzene Derivatives. 22. Synthesis of Boratabenzene Salts from 2,4-Pentadienylboranes. Structure of [NMe3Ph][C5H5BMe]». Organometallics 14 (1): 471-480. doi:10.1021/om00001a064.
- ↑ Jäkle, F. (2006). «Boron: Organoboranes». Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons. ISBN 9780470862100. doi:10.1002/0470862106.ia028.