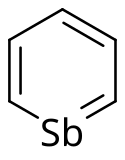
Estibabenceno
| Estibabenceno | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Estibinina | ||
| General | ||
| Fórmula molecular | C5H5Sb | |
| Identificadores | ||
| Número CAS | 289-75-8[1] | |
| ChemSpider | 119914 | |
| PubChem | 136137 | |
|
C1=CC=[Sb]C=C1
| ||
| Propiedades físicas | ||
| Masa molar | 186,85 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El estibabenceno, también conocido como estibinina, [2]es un compuesto químico orgánico con fórmula química C
5H
5Sb. Es un derivado del benceno, con uno de los átomos de carbono en el anillo de 6 miembros reemplazado por un átomo de antimonio (Sb). La estibinina es una molécula que se considera un compuesto de organoantimonio debido a que contiene átomos de carbono, hidrógeno y antimonio.
Síntesis de laboratorio
La síntesis de estibabenceno se puede realizar en un proceso de tres estapas. El producto final se puede aislar, aunque la molécula sea muy lábil. El primer paso de esta síntesis implica el tratamiento del penta-1,4-diino con dibutilestannano como se muestra en la figura siguiente:[3]
- C
5H
4 + Bu
2SnH
2 → C
13H
24Sn
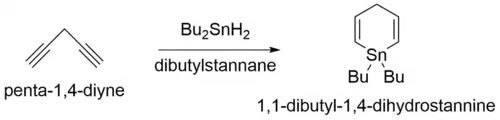
La segunda estapa de la síntesis implica la reacción del producto del primer paso, 1,1-dibutil-1,4-dihidrostannina, con tricloruro de antimonio, para producir 1-cloro-1-estibaciclohexa-2,5-dieno:[2]
- C
13H
24Sn + SbCl
3 → C
5H
6SbCl
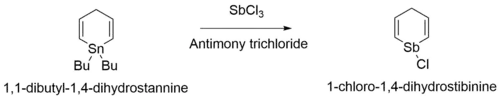
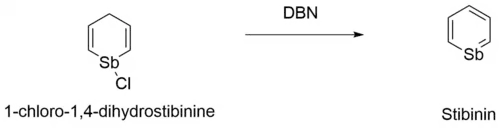
La etapa final de la síntesis de estibabenceno implica el tratamiento del 1-cloro-1-estibaciclohexa-2,5-dieno con una base, como DBN, para obtener el producto final de estibabenceno.
- C
5H
6SbCl + DBN → C
5H
6Sb
Compuestos similares
Se observa que otros derivados del benceno con un carbono reemplazado por un elemento del grupo 15 pueden sintetizarse a través de una vía sintética similar a la que se sintetiza el estibabenceno. La reacción de 1,1-dibutil-1,4-dihidrostannina con tricloruro de arsénico, tribromuro de fósforo o tricloruro de bismuto puede producir arsabenceno, fosfabenceno o 1-cloro-1-bismaciclohexa-2,5-dieno respectivamente. El tratamiento del 1-cloro-1-bismacociclohexa-2,5-dieno con una base, como DBN, puede producir el producto bismamenceno.[4]

Propiedades y reactividad
En comparación con los compuestos análogos con elementos más ligeros del grupo 15, el estibabenceno está significativamente distorsionado (véase en la figura inferior) y muestra una estabilización aromática considerablemente menor:
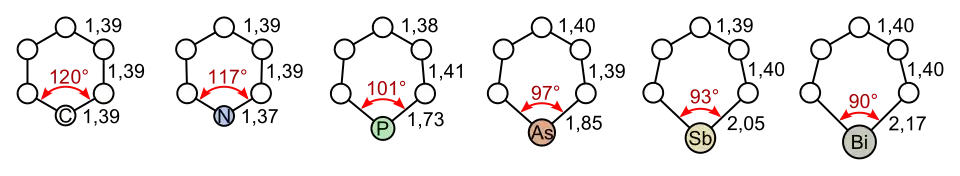
El estibabenceno se oxida fácilmente y también se polimeriza fácilmente.[5]
Véase también
- Anillos aromáticos de 6 miembros con un carbono reemplazado por otro grupo: borabenceno, silabenceno, germabenceno, estannabenceno, piridina, fosforina, arsabenceno, estibabenceno, bismabenceno, pirilio, tiopirilio, selenopirilio, teluropirilio
Referencias
- ↑ Número CAS
- ↑ a b Ashe, Arthur J. (December 1971). «Stibabenzene». Journal of the American Chemical Society (en inglés) 93 (24): 6690-6691. ISSN 0002-7863. doi:10.1021/ja00753a069.
- ↑ Ashe, Arthur J.; Fang, Xiangdong; Fang, Xinggao; Kampf, Jeff W. (December 2001). «Synthesis of 1,2-Dihydro-1,2-azaborines and Their Conversion to Tricarbonyl Chromium and Molybdenum Complexes». Organometallics (en inglés) 20 (25): 5413-5418. ISSN 0276-7333. doi:10.1021/om0106635.
- ↑ Ashe, Arthur J. (February 2016). «The Route to Phosphabenzene and Beyond». European Journal of Inorganic Chemistry (en inglés) 2016 (5): 572-574. ISSN 1434-1948. doi:10.1002/ejic.201600007.
- ↑ Elschenbroich, Christoph. «Organometallics». Wiley-VCH. ISBN 978-3-527-29390-2.