Triyoduro de boro
| Triyoduro de boro | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| triyodoborano | ||
| General | ||
| Fórmula estructural |
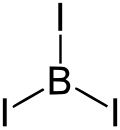 | |
| Fórmula molecular | BI3 | |
| Identificadores | ||
| Número CAS | 13517-10-7[1] | |
| ChemSpider | 75378 | |
| PubChem | 83546 | |
| Propiedades físicas | ||
| Densidad | 3350 kg/m³; 3,35 g/cm³ | |
| Masa molar | 391,722724 g/mol | |
| Punto de fusión | 49,9 °C (323 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El triyoduro de boro es un compuesto químico de boro y yodo con fórmula química BI3 . Tiene una geometría molecular trigonal plana .
Preparación
El triyoduro de boro puede prepararse mediante la reacción del boro con yodo a 209,5 °C o 409,1 °F, o haciendo reaccionar ácido hidróyodico con tricloruro de boro.
- 3HI + BCl
3 → BI
3 + 3HCl (Esta reacción requiere una temperatura elevada.)
Otro método es hacer reaccionar el borohidruro de litio con yodo. Además del triyoduro de boro, esta reacción también produce yoduro de litio, hidrógeno y yoduro de hidrógeno : [2]
- 3LiBH
4 + 8I
2 → 3LiI + 3BI
3 + 4H
2 + 4HI
Propiedades
En estado puro, el triyoduro de boro forma cristales incoloros, aunque pueden presentar un ligero tono rojizo, que son brillantes, sensibles al aire y a la hidrólisis,[3] y tienen una estructura cristalina hexagonal (a = 699,09 ± 0,02 pm, c = 736,42 ± 0,03 pm, grupo espacial P63/m (grupo espacial n.º 176)).[4] El triyoduro de boro es un ácido de Lewis fuerte y soluble en disulfuro de carbono. [2]
El triyoduro de boro reacciona con el agua y se descompone en ácido bórico y ácido yodhídrico:
- BI
3 + 3H
2O ⇌ B(OH)
3 + 3HI
Su constante dieléctrica es 5,38 y su calor de vaporización es 40,5 kJ/mol. A presiones extremadamente altas, el B 3 se vuelve metálico a ~23 GPa y es un superconductor por encima de ~27 GPa. [5]
Aplicaciones
El triyoduro de boro se puede utilizar para producir otros compuestos químicos y como catalizador (por ejemplo en la licuefacción del carbón ). [6]
Referencias
- ↑ Número CAS
- ↑ a b Handbuch der präparativen anorganischen Chemie. 2 (3., umgearb. Aufl edición). Stuttgart: Enke. 1978. ISBN 978-3-432-87813-3.
- ↑ «Beiträge zur Chemie der Bor-Stickstoff-Verbindungen». Archivado desde el original el 23 de septiembre de 2010. Consultado el 19 de septiembre de 2023.
- ↑ Albert, Barbara; Schmitt, Konny (May 2001). «Die Kristallstruktur von Bortriiodid, BI3». Zeitschrift für anorganische und allgemeine Chemie (en alemán) 627 (5): 809-810. ISSN 0044-2313. doi:10.1002/1521-3749(200105)627:5<809::AID-ZAAC809>3.0.CO;2-J.
- ↑ Hamaya, Nozomu; Ishizuka, Miyuki; Onoda, Suzue; Guishan, Jiang; Ohmura, Ayako; Shimizu, Katsuya (2010). «Pressure-induced phase transition, metallization, and superconductivity in boron triiodide». Physical Review B 82 (9): 094506. Bibcode:2010PhRvB..82i4506H. doi:10.1103/PhysRevB.82.094506.
- ↑ «Kohleverflüssigung – Innovations Report». www.innovations-report.de. 11 de enero de 2006. Consultado el 19 de septiembre de 2023.
Enlaces externos
- Esta obra contiene una traducción derivada de «Boron triiodide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.