Trióxido de xenón
| Trióxido de xenón | ||
|---|---|---|
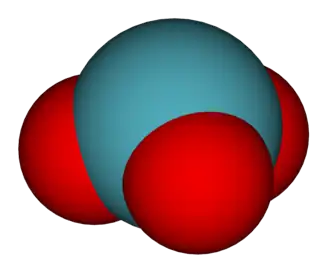 | ||
| General | ||
| Fórmula estructural |
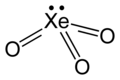 | |
| Fórmula molecular |
XeO 3 | |
| Identificadores | ||
| Número CAS | 13776-58-4[1] | |
| ChemSpider | 21106493 | |
| UNII | IM8XMX5O5Q | |
|
O=Xe(=O)=O
| ||
| Propiedades físicas | ||
| Masa molar | 179,288 g/mol | |
| Peligrosidad | ||
| NFPA 704 |
0
4
4
OX
| |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El trióxido de xenón, XeO3, es un compuesto inestable del xenón en su estado de oxidación (VI). Es un agente oxidante muy potente y libera oxígeno del agua lentamente, acelerado por la exposición a la luz solar. Es peligrosamente explosivo al entrar en contacto con materiales orgánicos. Al detonar, se descompone liberando gas xenón y oxígeno.
Química
La síntesis de trióxido de xenón se lleva a cabo mediante hidrólisis acuosa del hexafluoruro de xenón, XeF6:[2]
Los cristales de trióxido de xenón resultantes son un potente agente oxidante y pueden oxidar la mayoría de las sustancias oxidables. Sin embargo, su acción es lenta, lo que reduce su utilidad. [3]
El trióxido de xenón es una sustancia muy inestable. Por encima de 25 °C, es muy propenso a explosiones violentas:
Al disolverse en agua se forma una solución ácida de ácido xénico , un ácido débil de pKa aproximadamente igual a 10:
Esta solución es estable a temperatura ambiente y carece de las propiedades explosivas del trióxido de xenón. Oxida cuantitativamente los ácidos carboxílicos a dióxido de carbono y agua.[4]
Estas soluciones ácidas de ion perxenato tienen propiedades fuertemente oxidantes llegando a convertir el ion manganoso (Mn(II)) en permanganato, MnO4-. Aunque no es fácil determinar el potencial estándar de reducción, se ha estimado que aproximadamente el correspondiente a la semirreacción
es Eº = 2.12 V, lo que indica claramente las poderosas propiedades oxidantes de esta sustancia.[5]
También se disuelve en soluciones alcalinas para formar xenatos, siendo el anión HXeO−
4 la especie predominante en las soluciones resultantes.[6] Estos xenatos no son estables y dismutan en perxenatos (estado de oxidación (VIII)) y gas xenón y oxígeno.[7] Perxenatos sólidos que contienen XeO4−
6 han sido aislados mediante la reacción XeO
3 con una solución acuosa de hidróxidos.
El trióxido de xenón reacciona con fluoruros inorgánicos como KF, RbF o CsF para formar sólidos estables tipo MXeO
3F.[8]
Finalmente, el 15-corona-5 se coordina con el trióxido de xenón para dar un complejo estable a temperatura ambiente frente a choques mecánicos.[9]
Propiedades físicas
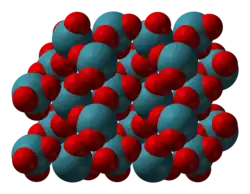
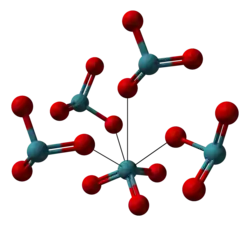
La hidrólisis del hexafluoruro o tetrafluoruro de xenón produce una solución a partir de la cual se pueden obtener cristales incoloros de XeO3 por evaporación.[2] Los cristales son estables durante varios días si se mantienen en aire seco, pero absorben fácilmente el agua del aire húmedo para formar una solución concentrada. La estructura cristalina es ortorrómbica con a = 6,163 Å, b = 8,115 Å, c = 5,234 Å y 4 moléculas por celda unidad. La densidad es de 4,55 g/cm3.[10]

|
|
|
| Modelo de barra y esferas de parte de la estructura cristalina del XeO3 |
Modelo de espacio completo | Geometría de coordinación de XeO3 |
Seguridad
El XeO3 debe manejarse con mucha precaución. Las muestras pueden detonar, sin tocarlas, a temperatura ambiente. Los cristales secos reaccionan explosivamente con la celulosa.[11]
Véase también
Referencias
- ↑ Número CAS
- ↑ a b John H. Holloway; Eric G. Hope (1998). A. G. Sykes, ed. Recent Advances in Noble-gas Chemistry. Advances in Inorganic Chemistry, Volume 46. Academic Press. p. 65. ISBN 0-12-023646-X.
- ↑ Greenwood, N.; Earnshaw, A. (1997). Chemistry of the Elements. Oxford: Butterworth-Heinemann.
- ↑ Jaselskis B.; Krueger R. H. (July 1966). «Titrimetric determination of some organic acids by xenon trioxide oxidation». Talanta 13 (7): 945-949. PMID 18959958. doi:10.1016/0039-9140(66)80192-3.
- ↑ MAHAN, Bruce M.; MYERS, Rollie J. (1990). «Cap.15.4 LOS COMPUESTOS DE LOS GASES NOBLES». QUlMlCA. Curso universitario (4 edición). Wilmington, Delaware: Addison-Wesley Iberoamericana. ISBN 0-201-64419-3.
- ↑ Peterson, J. L.; Claassen, H. H.; Appelman, E. H. (March 1970). «Vibrational spectra and structures of xenate(VI) and perxenate(VIII) ions in aqueous solution». Inorganic Chemistry 9 (3): 619-621. doi:10.1021/ic50085a037.
- ↑ W. Henderson (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. pp. 152–153. ISBN 0-85404-617-8.
- ↑ Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. p. 399. ISBN 0-12-352651-5.
- ↑ Marczenko, Katherine Mary; Mercier, Hélène Paule Anne; Schrobilgen, Gary J. «A stable crown ether complex with a noble-gas compound». Angewandte Chemie (Wiley-VCH). doi:10.1002/anie.201806640.
- ↑ Templeton, D. H.; Zalkin, A.; Forrester, J. D.; Williamson, S. M. (1963). «Crystal and Molecular Structure of Xenon Trioxide». Journal of the American Chemical Society 85 (6): 817. doi:10.1021/ja00889a037.
- ↑ Bartlett, N.; Rao, P. R. (1963). «Xenon Hydroxide: an Experimental Hazard». Science 139 (3554): 506. Bibcode:1963Sci...139..506B. PMID 17843880. doi:10.1126/science.139.3554.506.
