Manganato de bario
| Manganato de bario | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula molecular | BaMnO4 | |
| Identificadores | ||
| Número CAS | 7787-35-1[1] | |
| ChemSpider | 2341155 | |
| PubChem | 129690501 3084030, 129690501 | |
| UNII | R6Q81342Z4 | |
| Propiedades físicas | ||
| Densidad | 4850 kg/m³; 4,85 g/cm³ | |
| Masa molar | 256,823 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
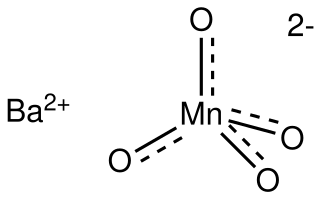
El manganato de bario es un compuesto inorgánico de fórmula BaMnO4 que se utiliza como oxidante en química orgánica.[2] Pertenece a una clase de compuestos conocidos como manganatos, en los que el manganeso presenta un estado de oxidación +6. No debe confundirse con el permanganato, que contiene manganeso (VII). El manganato de bario es un potente oxidante muy usado en síntesis orgánica y puede utilizarse en una amplia variedad de reacciones de oxidación.
Propiedades
El ion manganato (VI) es d1 y tetraédrico, con ángulos de enlace de aproximadamente 109,5°. Las longitudes de enlace Mn-O en BaMnO4 y K2MnO4 son idénticas, 1,66 Å. En comparación, la longitud del enlace Mn-O en MnO2−
4es más larga, 1,56 Å, que en MnO4−, y más corta que el enlace Mn-O encontrado en MnO2, 1,89 Å. [3][4] El manganato de bario es isomorfo con el BaCrO4 y el BaSO4. El manganato de bario puede aparecer en forma de cristales de color azul oscuro, verde o negro.[5] El manganato de bario es indefinidamente estable, activo y puede almacenarse durante meses en condiciones secas.[5]
Preparación
El manganato de bario se puede preparar a partir de manganato de potasio y cloruro de bario mediante metátesis de sal para dar manganato de bario insoluble:
- BaCl
2 + K
2MnO
4 → 2 KCl + BaMnO
4↓
Aplicaciones
El manganato de bario oxida una serie de grupos funcionales de forma eficaz y selectiva: alcoholes a carbonilos, dioles a lactonas, tioles a disulfuros, aminas aromáticas a compuestos azoicos, hidroquinona a p-benzoquinona, bencilamina a benzaldehído, hidrazonas a compuestos diazoicos, etc.[6] No oxida hidrocarburos saturados, alquenos, cetonas insaturadas ni aminas terciarias. El manganato de bario es un sustituto común del MnO2. Es más fácil de preparar, reacciona con mayor eficacia y las relaciones sustrato:oxidante se acercan más a la teoría.
Otro uso del manganato de bario era como reactivo en la síntesis del pigmento inorgánico azul de manganeso, que ya no se produce a escala industrial.
Referencias
- ↑ Número CAS
- ↑ Garry Procter, Steven V. Ley, Grant H. Castle, "Barium Manganate" Encyclopedia of Reagents for Organic Synthesis 2001. doi 10.1002/047084289X.rb003
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984).
- ↑ Jellinek, F. (1960-05). «On barium manganate and some related compounds». Journal of Inorganic and Nuclear Chemistry (en inglés) 13 (3-4): 329-331. doi:10.1016/0022-1902(60)80316-8. Consultado el 4 de junio de 2025.
- ↑ a b Firouzabadi, H.; Mostafavipoor,Z.
- ↑ Encyclopedia of Reagents for Organic Synthesis (en inglés) (1 edición). Wiley. 15 de abril de 2001. ISBN 978-0-471-93623-7. doi:10.1002/047084289x. Consultado el 4 de junio de 2025.
Enlaces externos
- Esta obra contiene una traducción derivada de «Barium manganate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.