Fluoruro de hierro (III)
| Fluoruro de hierro | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula molecular | FeF3 | |
| Identificadores | ||
| Número CAS | 7783-50-8[1] | |
| Número RTECS | NO6865000 | |
| ChemSpider | 22958 | |
| PubChem | 9833942 24552, 9833942 | |
| UNII | 0309P36Q66 | |
| Propiedades físicas | ||
| Masa molar | 112,93 g/mol | |
El fluoruro de hierro (III), también conocido como fluoruro férrico, son compuestos inorgánicos con la fórmula FeF3(H2O)x donde x = 0 o 3. El fluoruro de hierro (III) anhidro es blanco, mientras que las formas hidratadas son de color rosa claro. [2]
Propiedades químicas y físicas
El fluoruro de hierro (III) es un sólido antiferromagnético [3]térmicamente robusto, formado por centros de Fe(III) de alto espín, lo que concuerda con los colores pálidos de todas las formas de este material. Tanto el fluoruro de hierro(III) anhidro como sus hidratos son higroscópicos.
Estructura
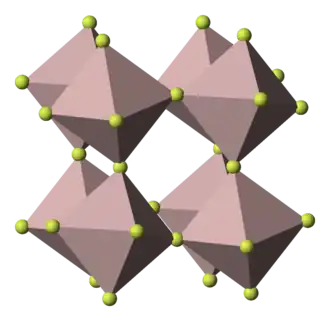
La forma anhidra adopta una estructura simple con centros octaédricos Fe(III)F6 interconectados por enlaces lineales Fe-F-Fe. En cristalografía, se clasifican como romboédricos con un grupo espacial R-3c.[4] El motivo estructural es similar al observado en el trióxido de renio. Aunque el sólido no es volátil, se evapora a altas temperaturas y el gas, que se obtiene a 987 °C, consiste en FeF3, una molécula plana de simetría D3h con tres enlaces Fe-F iguales, cada uno de longitud 176,3 pm.[5]A temperaturas muy altas, se descompone para dar FeF2 y F2.[4]
Se conocen dos formas cristalinas, o más técnicamente, polimorfos, del FeF3·3H2O: las formas α y β. La forma α se prepara por evaporación de una solución de HF que contiene Fe3+ a temperatura ambiente, mientras que la forma β se prepara por evaporación de dicha solución a una temperatura superior a 50 °C. La forma α sólida es inestable y se convierte en la forma β en cuestión de días. Las dos formas se distinguen por la diferencia en el desdoblamiento cuadrupolar de sus espectros Mössbauer.[6]
Preparación y reacciones
El fluoruro de hierro(III) anhidro se obtiene tratando prácticamente cualquier compuesto de hierro anhidro con flúor. De forma más práctica y como la mayoría de los fluoruros metálicos, se prepara tratando el cloruro correspondiente con fluoruro de hidrógeno.
- FeCl3 + 3 HF → FeF3 + 3 HCl
También se forma como película pasivante al entrar en contacto el hierro (y el acero) con el fluoruro de hidrógeno.[7] Los hidratos cristalizan a partir de ácido fluorhídrico acuoso.[6]
El material es un aceptor de fluoruro. Con hexafluoruro de xenón se forma [FeF4][XeF5].[4]
El FeF3 puro aún no se conoce entre los minerales. Sin embargo, su forma hidratada se conoce como el rarísimo mineral fumarólico topsøeita. Generalmente un trihidrato, su química es ligeramente más compleja: FeF[F0.5(H2O)0.5]4·H2O. [8] [9]
Aplicaciones
El principal uso comercial del fluoruro de hierro (III) es la producción de cerámica.[10]
Algunas reacciones de acoplamiento cruzado están catalizadas por compuestos basados en fluoruro férrico. Específicamente, el acoplamiento de compuestos de biarilo es catalizado por complejos de fluoruro de hierro (II) hidratado con ligandos carbeno N-heterocíclicos. Otros fluoruros metálicos también catalizan reacciones similares. [11] [12] También se ha demostrado que el fluoruro de hierro (III) cataliza la adición quimioselectiva de cianuro a los aldehídos para dar las cianhidrinas.[13]
Seguridad
El material anhidro es un potente agente deshidratante. La formación de fluoruro férrico podría haber sido la causa de la explosión de un cilindro de gas fluoruro de hidrógeno. [14]
Referencias
- ↑ Número CAS
- ↑ Housecroft, Catherine E.; Sharpe, Alan G. (2008) Inorganic Chemistry (3rd ed.), Pearson: Prentice Hall. ISBN 978-0-13-175553-6
- ↑ Wollan, E. O.; Child, H. R.; Koehler, W. C.; Wilkinson. M. K. (November 1958). «Antiferromagnetic properties of the iron group trifluorides». Physical Review 112 (4): 1132-1136. Bibcode:1958PhRv..112.1132W. doi:10.1103/PhysRev.112.1132.
- ↑ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2ª ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Hargittai, M.; Kolonits, M.; Tremmel, J.; Fourquet. J.; Ferey, G. (January 1990). «The molecular geometry of iron trifluoride from electron diffraction and a reinvestigation of aluminum trifluoride». Structural Chemistry 1 (1): 75-78. S2CID 96178006. doi:10.1007/BF00675786.
- ↑ a b Karraker, D. G.; Smith, P. K. (March 1992). «α- and β-FeF3•3H2O Revisited: Crystal Structure and 57Fe Mössbauer Spectra». Inorganic Chemistry 31 (6): 1118-1120. doi:10.1021/ic00032a042.
- ↑ J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, J. P. Cuer, "Fluorine Compounds, Inorganic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi 10.1002/14356007.a11_307
- ↑ «Topsøeite».
- ↑ «List of Minerals». 21 de marzo de 2011.
- ↑ "Ferric Fluoride." CAMEO Chemicals. National Oceanic and Atmospheric Administration. Web. 7 Apr. 2010. <http://cameochemicals.noaa.gov/chemical/3468>
- ↑ Hatakeyama, T.; Nakamura M. (July 2007). «Iron-Catalyzed Selective Biaryl Coupling: Remarkable Suppression of Homocoupling by the Fluoride Anion». Journal of the American Chemical Society 129 (32): 9844-9845. PMID 17658810. doi:10.1021/ja073084l.
- ↑ Hatakeyama, T.; Hashimoto, S.; Ishizuka, K.; Nakamura, M. (July 2009). «Highly Selective Biaryl Cross-Coupling Reactions between Aryl Halides and Aryl Grignard Reagents: A New Catalyst Combination of N-Heterocyclic Carbenes and Iron, Cobalt, and Nickel Fluorides». Journal of the American Chemical Society 131 (33): 9844-9845. PMID 19639999. doi:10.1021/ja9039289.
- ↑ Bandgar, B. T.; Kamble, V. T. (July 2001). «Organic Reactions in aqueous medium: FeF3 catalyzed chemoselective addition of cyanotrimethylsilane to aldehydes». Green Chemistry 3 (5): 265. doi:10.1039/b106872p.
- ↑ «A recent explosion of a lecture-size cylinder of hydrogen fluoride ... has renewed concerns that compressed gas cylinders can be especially dangerous.». University of California San Francisco. Archivado desde el original el 1 de septiembre de 2006.
Enlaces externos
- Inventario Nacional de Contaminantes: Hoja informativa sobre fluoruro y compuestos
- CAMEO Chemicals: Base de datos de materiales peligrosos
- Esta obra contiene una traducción derivada de «Iron(III) fluoride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.