Fluoruro de cesio
| Fluoruro de cesio | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula molecular | CsF | |
| Identificadores | ||
| Número CAS | 13400-13-0[1] | |
| Número RTECS | FK9650000 | |
| ChemSpider | 24179 | |
| PubChem | 25953 | |
| UNII | T76A371HJR | |
| Propiedades físicas | ||
| Densidad | 4640 kg/m³; 4,64 g/cm³ | |
| Masa molar | 151,904 g/mol | |
| Punto de fusión | 703 °C (976 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El fluoruro de cesio es un compuesto inorgánico con la fórmula CsF. El fluoruro de cesio, una sal blanca higroscópica, se utiliza en la síntesis de compuestos orgánicos como fuente del anión fluoruro.[2] El compuesto es destacable desde el punto de vista pedagógico ya que el cesio también tiene la electropositividad más alta de todos los elementos comúnmente disponibles y el flúor tiene la electronegatividad más alta.
Síntesis y propiedades
El fluoruro de cesio se puede preparar mediante la reacción de hidróxido de cesio (CsOH) con ácido fluorhídrico (HF) y la sal resultante puede luego purificarse mediante recristalización. La reacción se muestra a continuación:
- CsOH + HF → CsF + H2O
Utilizando la misma reacción, otra forma de crear fluoruro de cesio es tratar el carbonato de cesio (Cs₂CO₃) con ácido fluorhídrico. La sal resultante puede purificarse por recristalización. La reacción se muestra a continuación:
- Cs2CO 3 + 2 HF → 2 CsF + H2O + CO2
El CsF es más soluble que el fluoruro de sodio o el fluoruro de potasio en disolventes orgánicos. Está disponible en su forma anhidra y, si ha absorbido agua, es fácil de secar calentándolo a 100 °C. °C durante dos horas al vacío . [4] El CsF alcanza una presión de vapor de 1 kilopascal a 825 °C, 10 kPa a 999 °C y 100 kPa a 1249 °C. [5]
Estructura
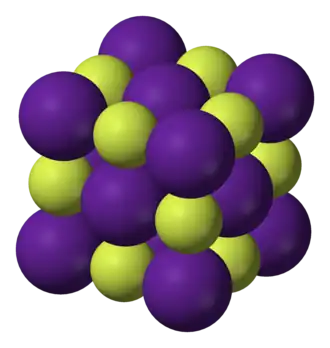
El fluoruro de cesio tiene la estructura de la halita, lo que significa que el Cs⁺ y el F⁻ se empaquetan en un conjunto cúbico similar al del Na⁺ y el Cl⁻ en el cloruro de sodio. A diferencia del cloruro de sodio, el anión del fluoruro de cesio es más pequeño que su catión, por lo que es el tamaño del anión el que inhibe estéricamente números de coordinación mayores que seis en condiciones normales. La coordinación de ocho, que se observa en otros cristales de haluro de cesio, estaría permitida por un ion haluro más grande.
Aplicaciones en síntesis orgánica
Al estar muy disociado, el CsF es una fuente de fluoruro más reactiva que las sales de metales alcalinos afines. El CsF es una alternativa al fluoruro de tetra-n-butilamonio (TBAF) y al fluoruro de TAS (TASF).
Como base
Al igual que otros fluoruros solubles, el CsF es moderadamente básico, porque el HF es un ácido débil. La baja nucleofilia del fluoruro significa que puede ser una base útil en la química orgánica.[6] El CsF produce mayores rendimientos en las reacciones de condensación de Knoevenagel que el KF o el NaF. [7]
Formación de enlaces Cs-F
El fluoruro de cesio se utiliza como fuente de fluoruro en la química organofluorada. Al igual que el fluoruro de potasio, el CsF reacciona con hexafluoroacetona para formar un sal de perfluoroalcóxido estable.[8] Convierte cloruros de arilo deficientes en electrones en fluoruros de arilo (proceso Halex), aunque el fluoruro de potasio se utiliza con más frecuencia.
Agente de desprotección
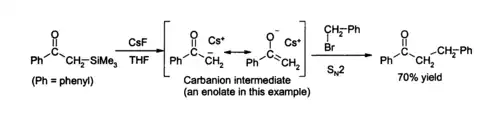
Debido a la fuerza del enlace Si – F, el fluoruro es útil para las reacciones de desililación, es decir, la escisión de enlaces Si-O en la síntesis orgánica. El CsF se utiliza comúnmente para tales reacciones. Las soluciones de fluoruro de cesio en THF o DMF atacan una amplia variedad de compuestos orgánicos de silicio para producir un fluoruro orgánico de silicio y un carbanión, que luego pueden reaccionar con electrófilos, por ejemplo: [7]
Precauciones
Al igual que otros fluoruros solubles, el CsF es moderadamente tóxico. [9] Se debe evitar el contacto con ácido, ya que éste forma ácido fluorhídrico, altamente tóxico y corrosivo. El ion cesio (Cs+) y el cloruro de cesio generalmente no se consideran tóxicos. [10]
Referencias
- ↑ Número CAS
- ↑
- ↑ Senga, Ryosuke; Suenaga, Kazu (2015). «Single-atom electron energy loss spectroscopy of light elements». Nature Communications 6: 7943. Bibcode:2015NatCo...6.7943S. PMC 4532884. PMID 26228378. doi:10.1038/ncomms8943.
- ↑ Friestad, G. K.; Branchaud, B. P. (1999). Reich, H. J.; Rigby, J. H., eds. Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents. New York: Wiley. pp. 99-103. ISBN 978-0-471-97925-8.
- ↑ Lide, D. R., ed. (2005). «Vapor Pressure». CRC Handbook of Chemistry and Physics (86th edición). Boca Raton (FL): CRC Press. p. 6.63. ISBN 0-8493-0486-5.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. pp. 82–83. ISBN 978-0-08-022057-4.
- ↑ a b Fiorenza, M; Mordini, A; Papaleo, S; Pastorelli, S; Ricci, A (1985). «Fluoride ion induced reactions of organosilanes: the preparation of mono and dicarbonyl compounds from β-ketosilanes». Tetrahedron Letters 26 (6): 787-788. doi:10.1016/S0040-4039(00)89137-6.
- ↑ Evans, F. W.; Litt, M. H.; Weidler-Kubanek, A. M.; Avonda, F. P. (1968). «Formation of adducts between fluorinated ketones and metal fluorides». Journal of Organic Chemistry 33 (5): 1837-1839. doi:10.1021/jo01269a028.
- ↑ «MSDS Listing for cesium fluoride». hazard.com. 27 de abril de 1993. Archivado desde el original el 9 de febrero de 2012. Consultado el 7 de septiembre de 2007.
- ↑ «MSDS Listing for cesium chloride». hazard.com. JT Baker. 16 de enero de 2006. Archivado desde el original el 13 de marzo de 2012. Consultado el 7 de septiembre de 2007.
Enlaces externos
- Esta obra contiene una traducción derivada de «Caesium fluoride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.