Difenilcetena
| Difenilcetena | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2,2-difeniletenona | ||
| General | ||
| Fórmula molecular | C14H10O | |
| Identificadores | ||
| Número CAS | 525-06-4[1] | |
| ChemSpider | 109691 | |
| PubChem | 123069 | |
| UNII | 50BG2854L0 | |
| Propiedades físicas | ||
| Apariencia | Líquido oleoso anaranjado | |
| Masa molar | 194,233 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La difenilcetena es una sustancia química de la familia de las cetenas. La difenilcetena, como la mayoría de las cetenas disustituidas estables, es un aceite de color rojo anaranjado a temperatura y presión ambiente. Debido a los dobles enlaces sucesivos en la estructura de la cetena R1R2C=C=O, la difenil cetena es un heterocumuleno. La reacción más importante de la difenilcetena es la cicloadición [2+2] a enlaces múltiples C=C, C=N, C=O y C=S.[2]
Historia
La difenil cetena fue aislada por primera vez por Hermann Staudinger en 1905 e identificada como el primer ejemplo de la clase excepcionalmente reactiva de cetenos[3] con la fórmula general R1R2C=C=O (R1=R2=grupo fenilo).[4]
Preparación
La primera síntesis de H. Staudinger se basó en el uso de cloruro de 2-clorodifenilacetilo (preparado a partir de ácido bencílico y cloruro de tionilo[5]) del que se escinden dos átomos de cloro utilizando zinc en una reacción de deshalogenación:[3]

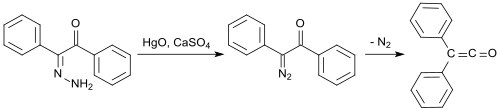
Una de las primeras síntesis descritas parte de bencilmonohidrazona (a partir de difeniletanodiona e hidrato de hidrazina[6]), que se oxida con óxido de mercurio (II) y sulfato de calcio para formar mono-diazocetona, y luego se convierte en difenilceteno a 100 °C bajo eliminación de nitrógeno con un rendimiento del 58%:
Otra de las primeras síntesis conocidas de la difenilcetena, la describió Eduard Wedekind, quien ya había obtenido difenilcetena en 1901 mediante la deshidrohalogenación de cloruro de difenilacetilo con trietilamina, sin embargo sin aislamiento ni caracterización.[7] Esta variante también fue descrita en 1911 por H. Staudinger.[8]

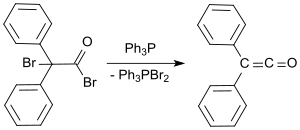
Un protocolo de laboratorio estándar se basa en el método de Staudinger y produce difenilcetena como un aceite naranja con rendimientos del 53-57%. En un proceso más reciente, el bromuro de 2-bromo-2,2-difenilacetilo se hace reaccionar con trifenilfosfina para producir difenilcetena con rendimientos de hasta el 81 %.[9]
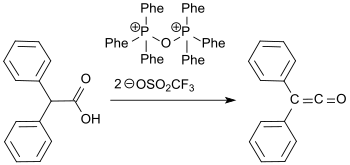
Recientemente, se ha informado de una síntesis de difenilcetena a partir de ácido difenilacético y el reactivo de Hendrickson (anhídrido de trifenilfosfonio-trifluorometanosulfonato)[10] con eliminación de agua con un rendimiento del 72%.[11]
Propiedades
La difenilcetena a temperatura ambiente es un aceite de color anaranjado-rojizo (como el color de una solución concentrada de dicromato de potasio[3]) que es miscible con disolventes orgánicos no polares (como éter etílico, acetona, benceno, tetrahidrofurano, cloroformo)[12] y se solidifica en frío formando cristales amarillos.[3] El compuesto se oxida fácilmente con el aire, pero se puede almacenar en recipientes bien cerrados a 0 °C durante varias semanas sin descomposición o en una atmósfera de nitrógeno con la adición de una pequeña cantidad de hidroquinona como inhibidor de la polimerización.
Reactividad
La difenilcetena puede sufrir ataques de una gran cantidad de nucleófilos, como alcoholes, aminas y enolatos, con velocidades bastante lentas. Estas velocidades pueden incrementarse en presencia de catalizadores. Actualmente se desconoce el mecanismo de reacción, pero se está trabajando para determinarlo.
La alta reactividad de la difenilcetena también se evidencia en la formación de tres dímeros:[13]
- La dicetona cíclica 2,2,4,4-tetrafenilciclobutano-1,3-diona (I) se obtiene calentando con quinolina.
- la β-lactona 4-(difenilmetileno)-3,3-difeniloxetan-2-ona (II) por calentamiento con metóxido de sodio y
- el derivado de tetralina 2,2,4-trifenilnaftaleno-1,3-(2H ,4H )-diona (III) por calentamiento con cloruro de benzoílo
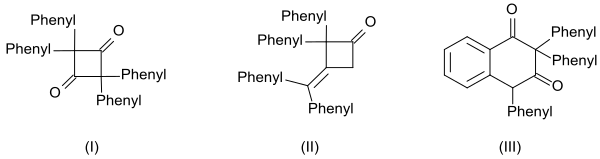
y oligómeros producidos a partir de ellos.
Aplicación
Las cetenas (de fórmula general R1R2C=C=O) tienen muchos paralelos con los isocianatos (de fórmula general RN=C=O) tanto en su constitución como en su reactividad.
La difenilcetena reacciona con agua en una reacción de adición para formar ácido difenilacético, con etanol para formar éster etílico de difenil acético o con amoníaco para formar la amida correspondiente.[3] Los ácidos carboxílicos producen anhídridos mixtos de ácido difenilacético, que pueden usarse para activar aminoácidos protegidos para la unión peptídica.
- Error al representar (error de sintaxis): {\displaystyle \ce{(Phenyl)2C=C=O ->[{}\atop\text{Z-Leu}] (Phenyl)2CO-O-CO-{}}\text{Z-Leu }\ce{->[{}\atop\ce{H-Phe-OEt}]}\text{ Z-Leu}\ce{-Phe-OEt}}
Mediante la activación de la Z-leucina con difenilcetena y la posterior reacción con el éster etílico de la fenilalanina, se obtiene el dipéptido protegido Z-Leu-Phe-OEt (éster etílico de N-benciloxicarbonil-L-leucil-L-fenilalanina) con un rendimiento del 59 %.[14]
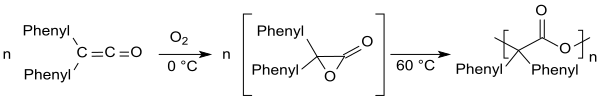
La difenilcetena es propensa a la autooxidación, en la que se forma el poliéster correspondiente a temperaturas superiores a 60 °C a través de un intermedio difenil acetolactona.[15]
En una reacción de Wittig, se pueden preparar alenos a partir de difenilcetena.[16]
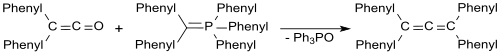
Con trifenilfosfina, difenilmetileno y difenilcetena, por ejemplo a 140 °C y bajo presión se forman alenos de tetrafenilo con un rendimiento del 70%.[17]
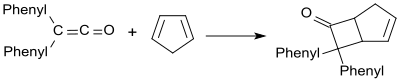
Las reacciones sintéticamente más interesantes de la difenilcetena son las cicloadiciones [2+2], por ejemplo la reacción con ciclopentadieno que produce un aducto de Diels-Alder.[18]
Las iminas como la benzalanilina forman β-lactamas con difenilcetena.
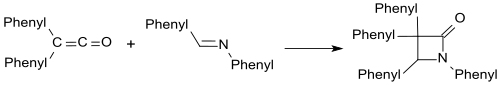
Con compuestos carbonílicos se forman de forma análoga las β-lactonas.[18]
La cicloadición [2+2] de la difenilcetena con fenilacetileno conduce primero a una ciclobutenona que se aromatiza térmicamente a una fenil vinil cetena y se cicla en una cicloadición [4+2] a 3,4-difenil-1-naftol con un rendimiento del 81%.[19]
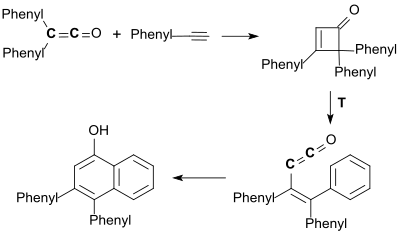
A partir de esta reacción, denominada de Smith-Hoehn, se ha desarrollado un método de síntesis general para fenoles y quinonas sustituidos.[4]
Referencias
- ↑ Número CAS
- ↑ Ulrich, H. (1967), Cycloaddition Reactions of Heterocumulenes, New York: Academic Press, p. 374.
- ↑ a b c d e Staudinger, H. (1905). «Ketene, eine neue Körperklasse». Ber. Dtsch. Chem. Ges. (en alemán) 38 (2): 1735-1739. doi:10.1002/cber.19050380283.
- ↑ a b Tidwell, T.T. (2005), «The first century of ketenes (1905–2005): The birth of a versatile family of reactive intermediates», Angew. Chem. 44 (36): 5778-5785, PMID 16149113, doi:10.1002/anie.200500098.
- ↑ King, F.E.; Holmes, D. (1947), «Synthetic mydriatics. Diphenylchloroacetyl chloride as a reagent for the preparation of benzylic esters of tertiary amino-alcohols», J. Chem. Soc.: 164-168, PMID 20238643, doi:10.1039/JR9470000164.
- ↑ Curtius, T.; Thun, K. (1891), «Einwirkung von Hydrazinhydrat auf Monoketone und Orthodiketone», J. Prakt. Chem. 44 (2): 161-186, doi:10.1002/prac.18910440121.
- ↑ Wedekind, E. (1901), «Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen», Ber. Dtsch. Chem. Ges. 34 (2): 2070-2077, doi:10.1002/cber.190103402122.
- ↑ Staudinger, H. (1911), «Über Ketene.XIX. Über Bildung und Darstellung des Diphenylketens», Ber. Dtsch. Chem. Ges. 44 (2): 1619-1623, doi:10.1002/cber.19110440258.
- ↑ Darling, S.D.; Kidwell, R.L. (1968), «Diphenylketene. Triphenylphosphine dehalogenation of .alpha.-bromodiphenylacetyl bromide», J. Org. Chem. 33 (10): 3974-3975, doi:10.1021/jo01274a074.
- ↑ McCauley, J.I. (2012), «Hendrickson reagent (triphenylphosphonium anhydride trifluormethane sulfonate», Synlett 23 (20): 2999-3000, doi:10.1055/s-0032-1317486.
- ↑ Moussa, Z. (2012), «The Hendrickson 'POP' reagent and analogues thereof: synthesis, structure, and application in organic synthesis», Arkivoc 2012 (1): 432-490, doi:10.3998/ark.5550190.0013.111.
- ↑ Leahy, J.W. (2001). «Diphenylketene». Encyclopedia of Reagents for Organic Synthesis. ISBN 0471936235. doi:10.1002/047084289X.rd421.
- ↑ Das, H.; Kooyman, E. C. (1965). «Oligomers of diphenylketene». Recueil des Travaux Chimiques des Pays-Bas 84 (8): 965-978. doi:10.1002/recl.19650840802.
- ↑ Losse, G.; Demuth, E. (1961), «Diphenylketen als Reagens zur Knüpfung von Peptidbindungen», Ber. Dtsch. Chem. Ges. (en alemán) 94 (7): 1762-1766, doi:10.1002/cber.19610940713.
- ↑ Staudinger, H.; Dyckerhoff, K.; Klever, H.W.; Ruzicka, L. (1925), «Über Autoxidation organischer Verbindungen. IV.: Über Autoxidation der Ketene», Ber. Dtsch. Chem. Ges. (en alemán) 58 (6): 1079-1087, doi:10.1002/cber.19250580618.
- ↑ Wittig, G.; Haag, A. (1963), «Über Phosphin-alkylene als olefinbildende Reagenzien, VIII. Allelderivate aus Ketenen», Ber. Dtsch. Chem. Ges. (en alemán) 96 (6): 1535-1543, doi:10.1002/cber.19630960609.
- ↑ (Tesis) http://e-collection.library.ethz.ch/eserv/eth:21016/eth-21016-01.pdf. Falta el
|título=(ayuda) - ↑ a b Staudinger, H. (1907), «Zur Kenntnis der Ketene. Diphenylketen», Liebigs Ann. Chem. (en alemán) 356 (1–2): 51-123, doi:10.1002/jlac.19073560106.
- ↑ Smith, L.I.; Hoehn, H.H. (1939), «The reaction of diphenylketene and phenylacetylene», J. Am. Chem. Soc. 61 (10): 2619-2624, doi:10.1021/ja01265a015.