Colorimetría (método químico)

En física y química analítica, la colorimetría es una técnica de análisis físico-químico "utilizada para determinar la concentración de compuestos coloreados en solución".[1] El procedimiento habitual consiste en medir la cantidad de luz de una frecuencia o longitud de onda determinada, dentro del rango de radiación visible, que es absorbida por la disolución coloreada y compararla con las medidas realizadas en una o más disoluciones patrón de la misma sustancia a determinar. Las mediciones se llevan a cabo con un instrumento conocido como colorímetro, específicamente diseñado al efecto, que permite seleccionar longitudes de onda complementarias a la del color de la disolución de medida (no debe confundirse con el colorímetro triestímulo usado para medir los colores en general).
Fundamento
Desde la antigüedad se tiene conocimiento de sustancias que tienen color y de que mezclando esos colores se obtienen nuevos colores. Losquímicos de la Edad Moderna estudiaron las diversas sustancias que usaban y vieron la necesidad de medir las cantidades disueltas y hasta conocer qué clase de sustancia química estaban usando. Así fueron desarrollando sistemas de análisis muy engorrosos y complejos para hacer esas determinaciones. Con el tiempo se fueron dando cuenta de que casi todas las sustancias, tratadas de algún modo específico, desarrollaban color y que la intensidad de ese color estaba relacionado con la cantidad de sustancia a analizar. A medida que la ciencia y el conocimiento iban avanzando, se percataron que el color de las sustancias químicas está relacionado con su estructura molecular y que dependiendo de dicha estructura, las frecuencias adsorbidas pueden ser diferentes. La radiación electromagnética no absorbida es reflejada, en el caso de sustancias sólidas opacas, o transmitida cuando la sustancia química es transparente o se encuentra en disolución, siendo estas las causantes del color. En otras palabras, el color observado por el ojo humano es aquel que no ha sido absorbido y recibe el nombre de color complementario.[2] Así por ejemplo una sustancia muestra color azul porque absorbe radiación visible de longitud de onda próxima a 610 nm, que es la correspondiente al color anaranjado.[3]
| Región de la longitud de onda absorbida, nm | Color de la luz absorbida | Color complementario transmitido |
|---|---|---|
| 380-420 | Violeta | Amarillo-verde |
| 420-440 | Azul-violeta | Amarillo |
| 440-470 | Azul | Anaranjado |
| 470-500 | Verde-azul | Rojo |
| 500-520 | Verde | Púrpura |
| 520-550 | Amarillo-verde | Violeta |
| 550-580 | Amarillo | Azul violeta |
| 580-620 | Anaranjado | Azul |
| 620-680 | Rojo | Verde-azulado |
| 680-780 | Púrpura | Verde |

Esta propiedad de la materia en disolución es utilizada en el análisis químico para determinar la concentración de determinadas sustancias que se encuentran disueltas, basándose en el principio de que la absorbancia de una sustancia coloreada en disolución es proporcional a su concentración (Ley de Beer-Lambert), siendo mayor cuanto mayor es su concentración.[4]
Las primeras determinaciones colorimétricas realizadas con fines de análisis químico, se basaban en la comparación directa de los colores del analito con una serie de patrones de dicho analito en diferentes concentraciones. En estos procedimientos el ojo humano actuaba como detector y el cerebro como transductor. Para ello se utilizaban tubos de vidrio para comparación de colores, habitualmente conocidos como tubos Nessler, que se caracterizan por ser de volumen fijo, hechos de vidrio con fondo ópticamente plano y que están calibrados para conseguir un camino óptico uniforme. Se comparaba la intensidad de color del tubo de la muestra con los diferentes patrones hasta encontrar uno muy parecido en color e intensidad. Como fuente de radiación visible se utilizaba la misma luz natural en todo su intervalo de frecuencias, sin limitar parte del espectro. Puesto que el ojo humano no detecta por igual todos los colores y no es capaz de diferenciar tonalidades muy próximas, las diferencias de concentración entre dos patrones consecutivos tiene que ser superior al 5-10%, según los colores. En consecuencia, las desviaciones relativas en las medidas podían llegar a ser de hasta el 50%, si el color de la muestra se aproximaba al color intermedio entre dos patrones.
Colorímetros
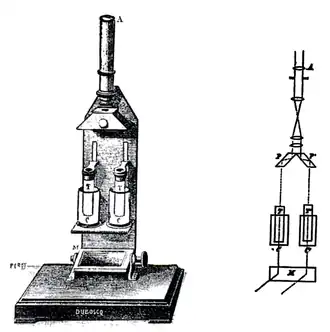
El empleo de este procedimiento de análisis colorimétrico, basado en tubos Nessler era largo y engorroso. El procedimiento se simplificó mediante el empleo de los colorímetros, nombre que recibieron los dispositivos utilizados para determinar la concentración de sustancias coloreadas en disolución. El primer dispositivo de medida que puede ser considerado como un colorímetro, fue el diseñado por el óptico francés fabricante de instrumentos, Jules Duboscq (1817-1886), considerado el primer colorímetro de la historia del análisis químico. Duboscq desarrolló un instrumento para estimar la concentración de la disolución que se basaba en la modificación del camino óptico recorrido por la luz a través de la muestra. Mediante un dispositivo se podía variar la altura de las muestras, y según fuera la relación entre la patrón y la muestra desconocida, se podía establecer la concentración de la misma. La luz necesaria era de origen natural y dirigida hacia la muestra mediante un espejo.[5] Varios instrumentos se desarrollaron según ese principio, desde simples comparadores ópticos hasta complejos instrumentos de medición.
Las medidas en esto colorímetros se llevaban a cabo utilizando una sola disolución patrón y empleaba el denominado procedimiento de compensación, que consistía en ir variando la distancia óptica (camino óptico) de la muestra hasta que la luz situada bajo los tubos, observada desde arriba, se aprecien con igual intensidad; es decir presenten la misma trasmisión. El colorímetro de Duboscq permite hacer esta operación de forma sencilla gracias al ocular de campo partido con el que está dotado. Considerando la Ley de Beer-Lambert y llamando Ax a la absorbancia de la muestra y As a la del patrón:
De esta manera y de forma sencilla, conocida la concentración de la disolución de referencia y las longitudes de los caminos ópticos en cada uno de los tubos, se podía establecer la concentración del analito en el tubo de muestra.
Fotocolorímetros
Con la aparición de la electrónica y de las células fotovoltaicas, capaces de producir una corriente eléctrica proporcional a la intensidad de la luz que llega a ella, empezaron a diseñarse colorímetros más precisos, a veces también denominados fotocolorímetros o fotómetros. En estos dispositivos se sustituye el ojo humano por un detector electrónico menos subjetivo, como es la fotocélula y como fuente de iluminación, una pequeña lámpara de filamento de wolframio, cuyo comportamiento se asemeja a un emisor de cuerpo negro, que a la temperatura de incandescencia emite luz visible e infrarroja. Puesto que las leyes de absorción de la radiación (Ley de Beer) solo se cumple cuando se utiliza luz monocromática, los fotocolorímetros más simples suelen estar dotados de filtros o juegos de filtros que se interponen entre la fuente de luz visible y la muestra, eliminado la mayor parte de la radiación no absorbida, permitiendo solamente la transmisión de un estrecho margen de longitudes de onda.[6] En este tipo de dispositivos, la determinación de la concentración de analito en la muestra problema se hace midiendo la cantidad de luz que atraviesa la disolución, comparando la cantidad entrante y la lectura de la cantidad absorbida. La operación se repite para una serie de patrones de concentración conocida de soluto y los resultados se representan como medidas de absorbancia respecto a concentración. Por interpolación de la absorbancia en la gráfica se puede encontrar el valor de la concentración desconocida de la muestra.
Tras la Segunda Guerra Mundial comenzaron a desarrollarse instrumentos que permitían la selección de longitud de onda con mayor precisión al disponer de prismas ópticos o de redes de difracción. Esto nuevos instrumento, además, estaban dotados de fuentes de emisión que cubren tanto el ultravioleta como el visible y el infrarrojo próximo (desde 190 nm a 1800 nm) y de detectores mucho más sensibles que la fotocélula, como por ejemplo, los denominados tubos fotomultiplicadores. Estos instrumentos más sofisticados y precisos son capaces de registrar tanto espectros completos como de realizar medidas de absorción a longitudes de onda determinadas, por lo que reciben el nombre común de espectrofotómetros. En consecuencia, la técnica de análisis, al no circunscribirse exclusivamente al intervalo de radiación visible, se denomina espectrofotometría de absorción molecular ultravioleta-visible o más corrientemente espectrofotometría uv-vis, aunque todavía, en la actualidad, el término colorimetría no ha caído totalmente en desuso.
Ensayos colorimétricos
Las medidas de absorción en las regiones ultravioleta y visible se utilizan ampliamente para identificar y determinar una enorme cantidad de especies inorgánicas y orgánicas, siendo una de las herramientas más útiles con que cuenta el científico. Es de amplia aplicación en los laboratorios de análisis general, ambientales, forenses y clínicos en todo el mundo.[7] Muchos de los métodos espectroscópico de análisis basados en la radiación ultravioleta-visible tienen sus orígenes el los primeros métodos colorimétricos desarrollados por los químicos, especialmente aquellos destinados a analizar especies no absorbentes que pueden ser tratadas químicamente para que se conviertan en especies coloreadas.
Entre las características importantes de los métodos colorimétricos o fotométricos están:[7]
- Amplio rango de aplicabilidad, tanto para sistemas orgánicos como inorgánicos.
- Límites de detección de 10-4 a 10-5 M.
- Selectividad de moderada a alta.
- Relativa buena exactitud.
- Adquisición de datos fácil y adecuada.
Existen numerosas sustancias, tanto de origen orgánico como inorgánico, que presentan coloración de forma natural y que por consiguientes son susceptibles de ser determinadas mediante procedimientos colorimétricos. Muchos de los iones de los metales de transición presentan colores característicos cuando están en solución, pues forman complejos con el agua. En otros casos, para aquellas especies que no muestran color de forma natural o en disolución, es posible utilizar reactivos que experimentan un cambio de color medible en presencia del analito. Existen numerosos reactivos que reaccionan en forma más o menos selectiva con especies no absorbentes y generan productos fuertemente coloreados. También se utilizan a menudo para determinar especies absorbentes, como los iones de los metales de transición, ya que forman productos con absortividad molar de varios órdenes de magnitud superior a la de la especie antes de la reacción, con lo que se consiguen importantes mejoras en la selectividad del análisis. Entre los reactivos inorgánicos de uso frecuente están el ion tiocianato para el hierro, cobalto y molibdeno; peróxido de hidrógeno para el titanio, vanadio y cromo; y el ion yoduro para el bismuto, paladio y teluro. También existen agentes quelantes orgánicos, que forman complejos coloreados estables con diversos cationes, como por ejemplo el dietilditiocarbamato para la determinación del cobre, la ditizona para el plomo y la dimetilglioxima para el níquel.[7]
También se emplean métodos colorimétricos en bioquímica para probar la presencia de enzimas, compuestos específicos, anticuerpos, hormonas y muchos más analitos. Por ejemplo,
- El para-nitrofenilfosfato se convierte en un producto amarillo por la enzima fosfatasa alcalina.
- Coomassie Blue una vez que se une a las proteínas provoca un cambio de espectro, lo que permite la dosificación cuantitativa. Un ensayo colorimétrico similar, el ensayo de ácido bicinconínico, usa una reacción química para determinar la concentración de proteína.
- Los inmunoensayos ligados a enzimas utilizan anticuerpos complejados con enzimas para detectar antígenos. La unión del anticuerpo a menudo se deduce del cambio de color de reactivos como TMB.
Véase también
- Jules Duboscq
- Colorímetro Lovibond
- Turbidimetría
- Espectrofotometría
- Espectroscopia ultravioleta-visible
Referencias
- ↑ Housecroft, Catherine; Constable, Edwin (2006). Chemistry: an introduction to organic, inorganic, and physical chemistry. Pearson Education. pp. 349-353. ISBN 978-0-13-127567-6.
- ↑ «Colorimetry - The Theory of Colors | X-Rite». X-Rite. Archivado desde el original el 8 de febrero de 2024. Consultado el 11 de marzo de 2025.
- ↑ Harris, Daniel C. (1992). Análisis Químico Cuantitativo. Grupo Editorial Iberoamericana. p. 499. ISBN 970-625-003-4.
- ↑ Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch. (2015). «Cap. 24C. ABSORCIÓN DE LA RADIACIÓN». Fundamentos de química analítica. Cengage Learning. ISBN 978-607-519-937-6.
- ↑ Hudson, John (1994). «Chap. 14. Analytical Chemistry». The history of chemistry (en inglés) (reprinted edición). Chapman & Hall. ISBN 978-0-412-03651-4.
- ↑ Skoog, D. A.; Holler, F. J.; . Crouch, S. R. (2008). Principios de análisis instrumental. Mexico: Cengage Learning. p. 351. ISBN 607-481-390-6.
- ↑ a b c Skoog, D. A.; Holler, F. J.; . Crouch, S. R. (2008). «Cap.14D. Análisis cuantitativo mediante mediciones de absorción». Principios de análisis instrumental. Mexico: Cengage Learning. ISBN 607-481-390-6.