Tetracloruro de molibdeno
| Tetracloruro de molibdeno | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Tetracloruro de molibdeno | ||
| General | ||
| Otros nombres | Cloruro de molibdeno (IV) | |
| Fórmula molecular | MoCl4 | |
| Identificadores | ||
| Número CAS | 13320-71-3[1] | |
| ChEBI | 30634 | |
| ChemSpider | 9862053 75200, 9862053 | |
| PubChem | 11687326 83340, 11687326 | |
| UNII | 6417YBA168 | |
| Propiedades físicas | ||
| Masa molar | 237,78081892 g/mol | |
| Punto de fusión | 825 K (552 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tetracloruro de molibdeno es un compuesto inorgánico cuya fórmula empírica es MoCl4. El material existe en dos polimorfos, ambos sólidos paramagnéticos de color oscuro. Estos compuestos son de interés principalmente como precursores de otros complejos de molibdeno.
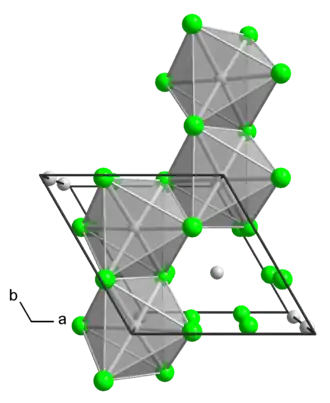
Estructura
El polimorfo α es un polímero. El polimorfo β es un hexámero. En ambos polimorfos, el centro de Mo es octaédrico, con dos ligandos cloruro terminales y cuatro ligandos doblemente puente.[2] Además de estas dos fases binarias, se conocen varios aductos con la fórmula MoCl4L2, donde L es una base de Lewis.
Preparación
El tetracloruro de α-molibdeno se puede preparar a partir de la decloración del pentacloruro de molibdeno con tetracloroeteno: [3]
- 2 MoCl5 + C2Cl4 → 2 MoCl4 + C2Cl6
El calentamiento de tetracloruro de α-molibdeno en un recipiente sellado en presencia de pentacloruro de molibdeno induce la conversión al polimorfo β. [3]
Reacciones
Cuando se calienta en un recipiente abierto, el tetracloruro de molibdeno desprende cloro, dando tricloruro de molibdeno; [3]
- 2 MoCl4 → 2 MoCl3 + Cl2
El aducto complejo de acetonitrilo se puede preparar reduciendo el pentacloruro con acetonitrilo: [4] [5]
- 2 MoCl5 + 5 CH3CN → 2 MoCl4(CH3CN)2 + ClCH2CN + HCl
Los ligandos MeCN se pueden intercambiar con otros ligandos:
- MoCl4(CH3CN)2 + 2 THF → MoCl4(THF)2 + 2 CH3CN
El pentacloruro puede reducirse al complejo éter MoCl4(Et2O)2 utilizando polvo de estaño. Es un sólido beige, paramagnético [6]
Referencias
- ↑ Número CAS
- ↑ Ulrich Müller (1981). «Hexameric Molybdenum Tetrachloride». Angewandte Chemie International Edition in English 20 (8): 692. doi:10.1002/anie.198106921.
- ↑ a b c McCann III, E. L.; Brown, T. M. (1970). «Molybdenum(IV) Chloride». Inorganic Syntheses. Inorganic Syntheses 12. p. 181. ISBN 9780470132432. doi:10.1002/9780470132432.ch31.
- ↑ Broderick, Erin M.; Browne, Samuel C.; Johnson, Marc J. A. (2014). «Dimolybdenum and Ditungsten Hexa(Alkoxides)». Inorganic Syntheses: Volume 36. Inorganic Syntheses 36. pp. 95-102. ISBN 9781118744994. doi:10.1002/9781118744994.ch18.
- ↑ Dilworth, Jonathan R.; Richards, Raymond L. (1990). «The Synthesis of Molybdenum and Tungsten Dinitrogen Complexes». Inorganic Syntheses. Inorganic Syntheses 28. p. 33. ISBN 9780470132593. doi:10.1002/9780470132593.ch7.
- ↑ Maria, Sébastien; Poli, Rinaldo (2014). «Ether Complexes of Molybdenum(III) and Molybdenum(IV) chlorides». Inorganic Syntheses: Volume 36. Inorganic Syntheses 36. pp. 15-18. ISBN 9781118744994. doi:10.1002/9781118744994.ch03.
Enlaces externos
- Esta obra contiene una traducción derivada de «Molybdenum tetrachloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.