Cloruro de molibdeno (III)
| Cloruro de molibdeno | ||
|---|---|---|
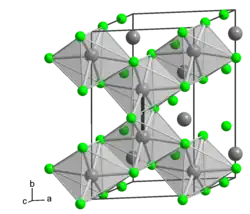 α-MoCl3 | ||
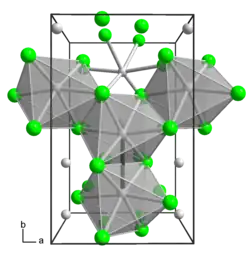 β-MoCl3 | ||
| General | ||
| Fórmula molecular | MoCl3 | |
| Identificadores | ||
| Número CAS | 13478-18-7[1] | |
| ChEBI | 30626 | |
| ChemSpider | 75350 | |
| PubChem | 9815611 83515, 9815611 | |
| UNII | 9D9PY7688B | |
| Propiedades físicas | ||
| Densidad | 3580 kg/m³; 3,58 g/cm³ | |
| Masa molar | 202,812 g/mol | |
| Punto de fusión | 683 K (410 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de molibdeno (III) es el compuesto inorgánico con la fórmula MoCl3. Forma cristales de color púrpura. [2]
Síntesis y estructura
El cloruro de molibdeno (III) se sintetiza mediante la reducción del cloruro de molibdeno (V) con hidrógeno. [3] Se obtiene un mayor rendimiento reduciendo el cloruro de molibdeno (V) puro con cloruro de estaño (II) anhidro como agente reductor. [4]
El tricloruro de molibdeno existe en dos polimorfos: alfa (α) y beta (β). La estructura alfa es similar a la del cloruro de aluminio (AlCl3). En esta estructura, el molibdeno tiene una geometría de coordinación octaédrica y presenta un empaquetamiento cúbico en su estructura cristalina. La estructura beta, sin embargo, presenta un empaquetamiento hexagonal. [5]
Complejos de éter
El tricloruro de molibdeno da lugar a complejos de éter MoCl3(thf)3 y MoCl3(Et2O)3. Son sólidos paramagnéticos de color beige. Ambos presentan centros octaédricos de Mo. El complejo de éter dietílico se sintetiza reduciendo una solución de Et2O de MoCl5 con polvo de estaño. [6] Los procedimientos más antiguos implican una reducción por etapas que permite aislar el complejo Mo(IV)-thf.[7]
El hexa(terc-butoxi)dimolibdeno(III) se prepara mediante la reacción de metátesis salina a partir del MoCl3(thf)3: [8]
- 2MoCl3(thf)3 +6LiOBu-t → Mo2(OBu-t)6 +6LiCl+6thf
Referencias
- ↑ Número CAS
- ↑ Perry, Dale L. (2011). Handbook of Inorganic Compounds (2nd edición). Boca Raton: Taylor & Francis. p. 279. ISBN 978-1-4398-1461-1.
- ↑ Couch DE, Brenner A (1959). «Preparation of Trichloride and Tetrachloride of Molybdenum». Journal of Research of the National Bureau of Standards Section A. 63A (2): 185-188. PMC 5287202. PMID 31216151. doi:10.6028/jres.063A.013.
- ↑ Larson, Melvin L. (1970). «Preparation of Some Metal Halides- Anhydrous Molybdenum Halides and Oxide Halides - A Summary». Inorganic Syntheses 12. pp. 178-181.
- ↑ Hillebrecht H, Schmidt PJ, Rotter HW, Thiele G, Zönnchen P, Bengel H, Cantow HJ, Magonov SN, Whangbo MH (1997). «Structural and scanning microscopy studies of layered compounds MCl3 (M= Mo, Ru, Cr) and MOCl2 (M= V, Nb, Mo, Ru, Os)». Journal of Alloys and Compounds 246 (1–2): 70-79. doi:10.1016/S0925-8388(96)02465-6.
- ↑ Maria, Sébastien; Poli, Rinaldo (2014). «Ether Complexes of Molybdenum(III) and Molybdenum(IV) chlorides». Inorganic Syntheses: Volume 36. Inorganic Syntheses 36. pp. 15-18. ISBN 9781118744994. doi:10.1002/9781118744994.ch03.
- ↑ Dilworth, Jonathan R.; Richards, Raymond L. (1990). «The Synthesis of Molybdenum and Tungsten Dinitrogen Complexes». Inorganic Syntheses. Inorganic Syntheses 28. pp. 33-43. ISBN 9780470132593. doi:10.1002/9780470132593.ch7.
- ↑ Broderick, Erin M.; Browne, Samuel C.; Johnson, Marc J. A. (2014). «Dimolybdenum and Ditungsten Hexa(Alkoxides)». Inorganic Syntheses: Volume 36. Inorganic Syntheses 36. pp. 95-102. ISBN 9781118744994. doi:10.1002/9781118744994.ch18.
Enlaces externos
- Esta obra contiene una traducción derivada de «Molybdenum(III) chloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.