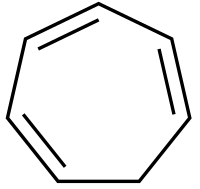
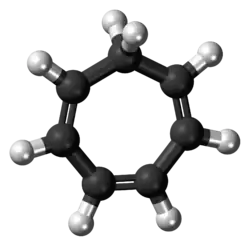
Cicloheptatrieno
| Cicloheptatrieno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ciclohepta-1,3,5-trieno | ||
| General | ||
| Otros nombres | 1H-[7]Anuleno | |
| Fórmula molecular | C7H8 | |
| Identificadores | ||
| Número CAS | 544-25-2[1] | |
| ChEBI | CHEBI:37519 | |
| ChemSpider | 10534 | |
| PubChem | 11000 | |
| UNII | P58Q106NTF | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 891,5 kg/m³; 0,8915 g/cm³ | |
| Masa molar | 92,14 g/mol | |
| Punto de fusión | −79,5 °C (194 K) | |
| Punto de ebullición | 116 °C (389 K) | |
| Peligrosidad | ||
| SGA |
    | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cicloheptatrieno (CHT) es un compuesto orgánico con la fórmula C7H8. Es un anillo cerrado de siete átomos de carbono unidos por tres enlaces dobles (como su nombre lo indica) y cuatro enlaces simples. Este líquido incoloro ha sido de interés teórico recurrente en la química orgánica. Es un ligando en la química organometálica y un componente básico en la síntesis orgánica. El cicloheptatrieno no es aromático, como lo refleja la no planaridad del puente de metileno (−CH
2−) con respecto a los otros átomos; sin embargo, el catión tropilio relacionado lo es, lo que hace que el compuesto sea relativamente susceptible a la oxidación.
Síntesis
Albert Ladenburg generó por primera vez cicloheptatrieno en 1881 mediante la descomposición de tropina.[2][3] La estructura fue finalmente demostrada mediante la síntesis de Richard Willstätter en 1901. Esta síntesis comenzó a partir de cicloheptanona y estableció la estructura de anillo de siete miembros del compuesto.[4]
El cicloheptatrieno se puede obtener en el laboratorio mediante la reacción fotoquímica del benceno con diazometano o la pirólisis del aducto de ciclohexeno y diclorocarbeno.[5] Una síntesis clásica relacionada con los derivados del cicloheptatrieno, la ampliación del anillo de Buchner, comienza con la reacción del benceno con diazoacetato de etilo para dar el éster etílico del norcaradieno correspondiente, que luego experimenta una expansión de anillo electrocíclica permitida térmicamente para dar el éster etílico del ácido 1,3,5-cicloheptatrieno 7-carboxílico.[6]

- Derivados seleccionados del cicloheptatrieno
-
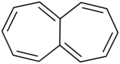 Heptaleno: compuesto por dos anillos de cicloheptatrieno fusionados.
Heptaleno: compuesto por dos anillos de cicloheptatrieno fusionados. -
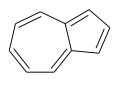 Azuleno: compuesto de anillos de ciclopentadieno y cicloheptatrieno fusionados.
Azuleno: compuesto de anillos de ciclopentadieno y cicloheptatrieno fusionados. -
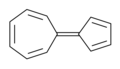 Sesquifulvaleno: compuesto por anillos de ciclopentadieno y cicloheptatrieno enlazados.
Sesquifulvaleno: compuesto por anillos de ciclopentadieno y cicloheptatrieno enlazados. -
 Elasovaleno: compuesto de un cicloheptatrieno y dos anillos de ciclopenteno fusionados.
Elasovaleno: compuesto de un cicloheptatrieno y dos anillos de ciclopenteno fusionados. -
 Tropona: compuesta por un anillo de cicloheptatrieno y un grupo carbonilo.
Tropona: compuesta por un anillo de cicloheptatrieno y un grupo carbonilo. -

-
 Hinokitiol – compuesto por un anillo de cicloheptatrieno, grupos isopropilo, carbonilo e hidroxi (isopropil cicloheptatrienolona).
Hinokitiol – compuesto por un anillo de cicloheptatrieno, grupos isopropilo, carbonilo e hidroxi (isopropil cicloheptatrienolona).
Reacciones
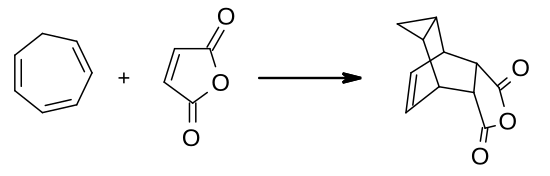
La eliminación de un ion hidruro del puente de metileno produce el catión cicloheptatrieno planar y aromático, también llamado ion tropilio. Una ruta práctica para este catión emplea PCl5 como oxidante.[7] El CHT se comporta como un dieno en las reacciones de Diels-Alder, por ejemplo con anhídrido maleico:[8]
Se conocen muchos complejos metálicos de cicloheptatrieno, incluidos Cr(CO)3(C7H8)[9] y cicloheptatrienomolibdeno tricarbonilo.[10]
3.png)
El ciclooctatetraeno y el cicloheptatrieno se utilizan como extintores de tripletes para láseres de colorante de rodamina 6G.[11][12]
Véase también
Referencias
- ↑ Número CAS
- ↑ A. Ladenburg (1883). «Die Constitution des Atropins». Justus Liebig's Annalen der Chemie 217 (1): 74-149. doi:10.1002/jlac.18832170107.
- ↑ A. Ladenburg (1881). «Die Zerlegung des Tropines». Berichte der Deutschen Chemischen Gesellschaft 14 (2): 2126-2131. doi:10.1002/cber.188101402127.
- ↑ Richard Willstätter (1901). «Synthesen in der Tropingruppe. I. Synthese des Tropilidens». Justus Liebig's Annalen der Chemie 317 (2): 204-265. doi:10.1002/jlac.19013170206.
- ↑ H.E. Winberg (1959). «Synthesis of Cycloheptatriene». Journal of Organic Chemistry 24 (2): 264-265. doi:10.1021/jo01084a635.
- ↑ For a variation: Irvin Smith Lee; Tawney Pliny O (1934). «Studies on the Polymethylbenzenes. IX. Addition of Ethyl Diazoacetate to Durene». J. Am. Chem. Soc. 56 (10): 2167-2169. doi:10.1021/ja01325a054.
- ↑ Conrow, K. (1973). «Tropylium Fluoroborate». Organic Syntheses, Collected Volume 5: 1138. doi:10.15227/orgsyn.043.0101.
- ↑ Ishitobi, Hiroyuki; Tanida, Hiroshi; Tori, Kazuo; Tsuji, Teruji (1971). «Re-examination of the Cycloaddition of Cycloheptatriene with Maleic Anhydride». Bulletin of the Chemical Society of Japan 44 (11): 2993-3000. doi:10.1246/bcsj.44.2993.
- ↑ James H. Rigby, Kevin R. Fales (2004). "7α-ACETOXY-(1Hβ, 6Hβ)-BICYCLO[4.4.1]UNDECA-2,4,8-TRIENE VIA CHROMIUM-MEDIATED HIGHER ORDER CYCLOADDITION". Org. Synth..
- ↑ Green, Malcolm L. H.; Ng, Dennis K. P. (1995). «Cycloheptatriene and -enyl Complexes of the Early Transition Metals». Chemical Reviews 95 (2): 439-473. doi:10.1021/cr00034a006.
- ↑ Tomi Nath Das; K. Indira Priyadarsini (1994). «Triplet of Cyclooctatetraene : Reactivity and Properties». Journal of the Chemical Society, Faraday Transactions 90 (7): 963-968. doi:10.1039/ft9949000963.
- ↑ R. Pappalardo; H. Samelson; A. Lempicki (1970). «Long Pulse Laser Emission From Rhodamine 6G Using Cyclooctatetraene». Applied Physics Letters 16 (7): 267-269. Bibcode:1970ApPhL..16..267P. doi:10.1063/1.1653190.