Bromuro de hierro (III)
| Bromuro de hierro (III) | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Otros nombres |
Bromuro férrico Tribromuro de hierro Tribromohierro | |
| Fórmula molecular | FeBr3 | |
| Identificadores | ||
| Número CAS | 10031-26-2[1] | |
| ChemSpider | 23830 | |
| PubChem | 82310 25554, 82310 | |
| UNII | 9RDO128EH7 | |
| Propiedades físicas | ||
| Densidad | 4500 kg/m³; 4,50 g/cm³ | |
| Masa molar | 292,6899488 g/mol | |
| Punto de fusión | 200 °C (473 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bromuro de hierro (III) es un compuesto químico de fórmula FeBr3. También conocido como bromuro férrico, este compuesto inodoro de color marrón rojizo se utiliza como catalizador ácido de Lewis en la halogenación de compuestos aromáticos. Se disuelve en agua para dar soluciones ácidas.
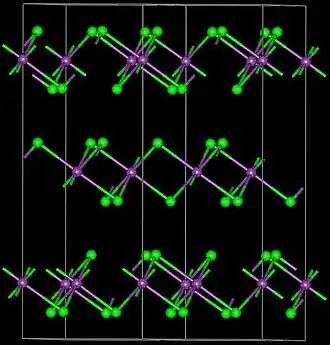
Estructura, síntesis y propiedades básicas
El FeBr3 forma una estructura polimérica que presenta centros de Fe octaédricos de seis coordenadas. [2] Aunque está disponible comercialmente a bajo costo, el FeBr3 se puede preparar mediante el tratamiento del metal hierro con bromo:
- 2 Fe + 3 Br2 → 2 FeBr3
Por encima de 200 °C, el FeBr3 se descompone bromuro ferroso:
- 2FeBr3 → 2FeBr2 + Br2
El cloruro de hierro (III) es considerablemente más estable, lo que refleja el mayor poder oxidante del cloro. El FeI3 no es estable, ya que el hierro (III) oxidará los iones de yoduro.
Usos
El bromuro férrico se utiliza ocasionalmente como oxidante en química orgánica, por ejemplo, para la conversión de alcoholes en cetonas. También se usa como catalizador de Lewis ácido para la bromación de compuestos aromáticos. Para estas últimas aplicaciones, suele generarse in situ. [3]
Véase también
- Bromuro de hierro (II), el bromuro inferior de hierro
Referencias
- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ↑ Drapeau, Martin Pichette; Lafantaisie, Mathieu; Ollevier, Thierry (2013). «Iron(III) bromide». E-EROS Encyclopedia of Reagents for Organic Synthesis. ISBN 978-0471936237. doi:10.1002/047084289X.rn01568.
Enlaces externos
- Esta obra contiene una traducción derivada de «Iron(III) bromide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.