Óxido de zinc
| Óxido de zinc | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Óxido de zinc | ||
| General | ||
| Otros nombres | Monóxido de zinc, óxido zínquico | |
| Fórmula molecular | ZnO | |
| Identificadores | ||
| Código ATC | A07XA91 | |
| Número CAS | 1314-13-2[1] | |
| Número RTECS | ZH4810000 | |
| ChEBI | 36560 | |
| ChEMBL | 3988900 | |
| ChemSpider | 14122 | |
| DrugBank | DB09321 | |
| PubChem | 14806 | |
| UNII | SOI2LOH54Z | |
| KEGG | C12570 | |
|
[Zn]=O
| ||
|
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco[2]: 4.95, 12.8 | |
| Olor | Inodoro | |
| Densidad | 5600 kg/m³; 5,6 g/cm³ | |
| Masa molar | 81,406 g/mol | |
| Punto de fusión | 2248 K (1975 °C) | |
| Punto de ebullición | 2633 K (2360 °C) | |
| Estructura cristalina | Hexagonal (tipo wurtzita)[2]: 4.145 | |
| Índice de refracción (nD) | n1=2.013, n2=2.029 [2]: 4.138, 10.251 | |
| Conductividad térmica | 0.6 W/(cm·K) | |
| Banda prohibida | 3.2 eV | |
| Propiedades químicas | ||
| Solubilidad en agua | 1.6 mg/L a 29 °C[3] | |
| Termoquímica | ||
| ΔfH0sólido | −350.46±0.27 kJ mol−1 kJ/mol | |
| S0sólido | 43.65±0.40 J·mol–1·K–1 | |
| Capacidad calorífica (C) | 40.3 J·mol-1·K-1 | |
| Peligrosidad | ||
| SGA |
 | |
| Punto de inflamabilidad | 1436 K (1163 °C) | |
| NFPA 704 |
0
2
0
| |
| Frases H | H400, H401 | |
| Frases P | P273, P391, P501 | |
| Riesgos | ||
| LD50 | 7950 mg/kg (ratas, oral) | |
| Compuestos relacionados | ||
| Compuestos con cloro |
Clorato de zinc Cloruro de zinc | |
| Compuestos con azufre |
Sulfato de zinc Sulfuro de zinc | |
| Otros aniones |
Seleniuro de zinc Telururo de zinc | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El óxido de zinc es un compuesto inorgánico con la fórmula ZnO. Es un polvo blanco insoluble en agua. El ZnO es comúnmente usado como aditivo en diversos materiales y productos, como por ejemplo: caucho, plásticos, cerámicas, vidrio, cemento, lubricantes,[4] pinturas, ungüentos, adhesivos, selladores, pigmentos, suplementos alimenticios, baterías, ferritas, retardadores de fuego y cintas de primeros auxilios. Aunque se encuentra de forma natural en el mineral cincita, la mayor parte del óxido de zinc se produce sintéticamente.[5]
El ZnO es un semiconductor del grupo de semiconductores II-VI. La adición de impurezas para modular sus propiedades eléctricas (dopaje) nativa del semiconductor debida a las vacantes del oxígeno o intersticiales de zinc es tipo N.[6]
Historia
Los compuestos de zinc fueron probablemente utilizados por los primeros humanos en formas procesadas[5] y sin procesar como pintura o ungüento medicinal; sin embargo, la composición de estas formas es incierta. El uso de pushpanjan, probablemente óxido de zinc, como bálsamo para los ojos y las heridas abiertas, es mencionado en el texto de medicina india Charaka-samhita, el cual se cree data del año 500 a. C. o antes.[7] El ungüento de óxido de zinc también es mencionado por el médico griego Dioscórides (siglo I d. C.).[8] Galeno sugirió tratar los cánceres ulcerosos con óxido de zinc,[9] al igual que Avicena en El canon de medicina (1025 d. C.) donde lo menciona como el tratamiento preferido para diversas condiciones en la piel, incluyendo cáncer de piel. Aunque en la actualidad ya no es usado para tratar el cáncer, el óxido de zinc se utiliza para tratar una amplia variedad de condiciones en la piel; en productos como talco para bebé y cremas contra la dermatitis provocada por el pañal (rozaduras), crema de calamina, champús anti-caspa, y ungüentos antisépticos.[10]
Los romanos producían cantidades considerables de latón (una aleación de zinc y cobre) ya en el año 200 a. C., mediante un proceso de cementación donde el cobre se hacía reaccionar con óxido de zinc.[11] Se cree que el óxido de zinc se producía al calentar mena de zinc en un horno de cuba. De este modo se liberaba zinc metálico como vapor, el cual después ascendía por el conducto de humos y se condensaba en forma de óxido. Este proceso fue descrito por Dioscórides en el siglo I d. C.[12] También se ha recuperado óxido de zinc de las minas de Zawar en Rajastán, India, que datan de la segunda mitad del primer milenio antes de Cristo.[8] Esto lo convierte en una de las minas de zinc más antiguas del mundo.[13]
Del siglo XII al XVI, el zinc y el óxido de zinc fueron reconocidos y producidos en India utilizando una forma primitiva de síntesis directa. Desde India, la manufactura de zinc se trasladó a China en el siglo XVII. En 1743, se estableció el primer horno de fundición europeo de zinc en Bristol, Reino Unido.[14] Hacia 1782, Louis-Bernard Guyton de Morveau propuso sustituir el pigmento blanco de plomo por óxido de zinc.[15]
El óxido de zinc (blanco de zinc) se uilizaba principalmente en pinturas y como aditivo en ungüentos. El blanco de zinc era aceptado como pigmento en pinturas al óleo en 1834, pero este no se mezclaba bien con el aglutinante a base de aceites. Este problema se solucionó al optimizar la síntesis del ZnO. En 1845, el economista y empresario francés Edme-Jean Leclaire (1801-1872) producía en París la pintura de óleo a gran escala, y para 1850 el blanco de zinc ya se fabricaba en toda Europa. El triunfo del blanco de zinc se debió a sus ventajas sobre el tradicional blanco de plomo: el blanco de zinc es esencialmente permanente bajo la luz del sol, no se ennegrece por aire que contenga azufre, no es tóxico y es más económico. Como el blanco de zinc es tan “limpio”, resulta muy útil para hacer tintes con otros colores, pero forma una película seca bastante quebradiza cuando no se mezcla con otros colores. Por ejemplo, a finales de la década de 1890 y principios de la década de 1900, algunos artistas utilizaron el blanco de zinc como base para sus pinturas al óleo. Con el paso de los años estas pinturas se agrietaron.[16]
En tiempos recientes, la mayor parte del óxido de zinc se ha utilizado en la industria del caucho para hacerlo resistente a la corrosión. En la década de 1970, la segunda mayor aplicación del ZnO era en la fotocopia. El ZnO de alta calidad, producido mediante el “proceso francés”, se añadía al papel de fotocopiado como relleno. Esta aplicación pronto fue desplazada por el titanio.[17]
Propiedades químicas
El ZnO puro es un polvo blanco. Sin embargo, en la naturaleza se encuentra de manera natural como el mineral cincita, el cual usualmente contiene manganeso y otras impurezas que le confieren un color entre amarillo y rojo.[18]
El óxido de zinc cristalino es termocrómico, cambiando de blanco a amarillo cuando se calienta en aire, y volviendo a blanco al enfriarse.[19] Este cambio de color se debe a una pequeña pérdida de oxígeno al ambiente a altas temperaturas para formar Zn1+xO no estequiométrico, donde a 800 °C, x = 0,00007.[19]
El óxido de zinc es un óxido anfótero. Es casi insoluble en agua, pero se disuelve en la mayoría de los ácidos, tales como el ácido clorhídrico:[20]
- ZnO + 2 HCl → ZnCl2 + H2O
Las bases también degradan este sólido para formar zincatos solubles:[20]
- ZnO + 2 NaOH + H2O → Na2[Zn(OH)4]
El ZnO reacciona lentamente con los ácidos grasos de los aceites para producir los correspondientes carboxilatos (base conjugada de un ácido carboxílico), tales como el oleato o el estearato. Cuando se mezcla con una solución acuosa fuerte de cloruro de zinc, el ZnO forma productos similares al cemento mejor conocidos como hidroxicloruros de zinc.[21] Este cemento se utilizaba en odontología.[22]

El ZnO también forma un material parecido al cemento cuando es tratado con ácido fosfórico; los materiales relacionados son usados en odontología.[22] El mayor compuesto producido por la reacción al formar el cemento de fosfato de Zinc es la hopeíta, Zn3(PO4)2·4H2O. [23]
El ZnO se descompone en vapor de zinc y oxígeno a unos 1975 °C con una presión de oxígeno estándar. En una reacción carbotérmica, el calentamiento con carbono convierte el óxido en vapor de zinc a una temperatura mucho más baja (alrededor de 950 °C).[20]
- ZnO + C → Zn(Vapor) + CO
El óxido de zinc puede reaccionar violentamente con polvo de aluminio y magnesio, con caucho clorado y aceite de linaza caliente provocando fuego y riesgo de explosión.[24][25]
Reacciona con sulfuro de hidrógeno para crear sulfuro de cinc. Esta reacción es usada comercialmente.[cita requerida]
- ZnO + H2S → ZnS + H2O
Propiedades físicas

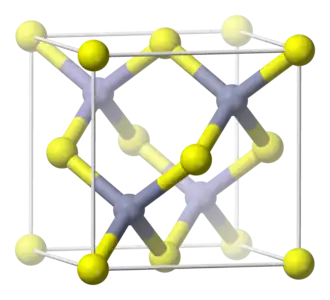
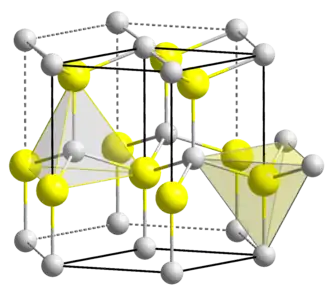
Estructura
El óxido de zinc se cristaliza en dos formas principales, wurtzita hexagonal[26] y zincblenda cúbica. La estructura wurtzita es la más estable en condiciones ambientales y, por lo tanto, la más común. La forma de zincblenda puede ser estabilizada al formar el ZnO en sustratos con estructura de red cúbica. En ambos casos, los centros de zinc y óxido son tetraédricos, la geometría más caacterística para el Zn(II). El ZnO se convierte en el patrón de sal de roca a presiones relativamente altas, de unos 10 GPa.[6]
Los polimorfos hexagonal[27] y zincblenda no tienen simetría de reflexión (la reflexión de un cristal respecto a un punto dado no lo transforma en sí mismo).[28] Ésta y otras propiedades de simetría de la red resultan en la piezoelectricidad del ZnO hexagonal[27] y zincblenda,[28] y a la piroelectricidad del ZnO hexagonal.[29]
La estructura hexagonal tiene el grupo puntual 6 mm (notación de Hermann-Mauguin) o C6v (notación de Schoenflies), y su grupo espacial es P63mc o C6v4. Los parámetros de red son a = 3,25 Å y c = 5,2 Å; con una proporción c/a ~ 1,60, cercano al valor ideal de una celda hexagonal c/a = 1,633.[30]
Como en la mayoría de los materiales de los grupos II-VI, el enlace en el ZnO es principalmente iónico (Zn2+O2−) con radios correspondientes de 0,074 nm para el Zn2+ y 0,140 nm para el O2−. Esta propiedad explica la formación preferente de la estructura wurtzita en lugar de zincblenda,[31] así como la fuerte piezoelectricidad del ZnO. Debido a los enlaces polares Zn−O, los planos de zinc y oxígeno están cargados eléctricamente. Para mantener la neutralidad eléctrica, esos planos se reconstruyen a nivel atómico en la mayoría de los materiales relativos, pero no en el ZnO: sus superficies son atómicamente planas, estables y no presentan reconstrucción.[32] Sin embargo, los estudios que utilizaron estructuras wurtzoides explicaron el origen de la planitud de la superficie y la ausencia de reconstrucción en las superficies wurtzitas del ZnO,[33] además del origen de las cargas en los planos del ZnO.
Propiedades mecánicas
El ZnO es un material relativamente blando con una dureza aproximada de 4,5 en la escala de Mohs.[4] Sus constantes elásticas son menores que aquellas de los semiconductores relevantes de los grupos III-V, tales como el GaN. La alta capacidad calorífica y conductividad térmica, la baja expansión térmica y la alta temperatura de fusión del ZnO son propiedades benéficas para las cerámicas.[17] El ZnO exhibe un fonón óptico E2 con un tiempo de vida inusualmente largo de hasta 133 ps a 10 K.[34]
Entre los semiconductores de enlace tetraédrico, se ha afirmado que el ZnO tiene el mayor tensor piezoeléctrico, o al menos uno comparable al del GaN y el AlN.[35] Esta propiedad lo convierte en un material de importancia tecnológica para diversas aplicaciones piezoeléctricas, las cuales requieren un gran acoplamiento mecánico. Por lo tanto, el ZnO en forma de lámina delgada ha sido uno de los materiales más estudiados y utilizados para resonadores acústicos de lámina delgada (en inglés: thin-film bulk acoustic resonator, FBAR o TFBAR).[36] Un TFBAR es un dispositivo formado por un material piezoeléctrico fabricado por métodos de película delgada entre dos electrodos conductores, normalmente metálicos, y aislado acústicamente del medio circundante. El funcionamiento se basa en la piezoelectricidad de la capa piezoeléctrica entre los electrodos.
Propiedades electrónicas y ópticas
Entre las propiedades favorables del óxido de zinc se encuentran su buena transparencia, su elevada movilidad electrónica, su amplia brecha energética (en inglés: band gap) y su fuerte luminiscencia a temperatura ambiente. Estas propiedades hacen del ZnO un material valioso para diversas aplicaciones emergentes: electrodos transparentes en pantallas de cristal líquido,[37] ventanas de ahorro energético o de protección contra el calor[18] y componentes electrónicos como transistores de película fina y diodos emisores de luz.[38]
El ZnO es un semiconductor del grupo de los semiconductores II-VI y tiene un band gap directo relativamente amplio de ~3,3 eV a temperatura ambiente. Entre las ventajas de un amplio band gap se encuentran voltajes de ruptura más altos, la capacidad de soportar campos eléctricos grandes, un menor ruido electrónico, y un funcionamiento a altas temperaturas y con gran potencia. El band gap del ZnO puede ser ajustado a alrededor de 3 o 4 eV mediante su aleación con óxido de magnesio u óxido de cadmio.[6] Debido a este gran band gap se han realizado esfuerzos para crear celdas solares visiblemente transparentes utilizando ZnO como capa absorbente de luz. Sin embargo, estas celdas solares han demostrado ser muy ineficaces.[39]
La mayor parte del ZnO tiene características de semiconductor tipo N, incluso en ausencia de dopaje intencionado.[6] La no estequiometría suele ser el origen del carácter tipo N, pero el tema sigue siendo controvertido.[40] Se ha propuesto una explicación alternativa, basada en cálculos teóricos, según la cual la sustitución no intencionada de las impurezas de hidrógeno es la responsable.[41] El dopaje de tipo N es controlable con facilidad al sustituir el zinc con elementos del grupo III como aluminio, galio, indio o al sustituir el oxígeno con elementos del grupo VII como cloro o yodo.[42]
El dopaje fiable de tipo P del ZnO aún es difícil. Este problema se origina de la baja solubilidad de los dopantes de tipo p y su compensación de las abundantes impurezas de tipo N. Este problema se observa con el GaN y el ZnSe. La medición del tipo P en materiales “intrínsecamente” tipo N se complica por la falta de homogeneidad de las muestras.[43]
Las limitaciones actuales del dopaje P restringen las aplicaciones electrónicas y optoelectrónicas del ZnO, que generalmente requieren uniones con materiales de tipo N y tipo P. Entre los dopantes de tipo P conocidos se incluyen a los elementos del grupo I litio, sodio y potasio; elementos del grupo V nitrógeno, fósforo y arsénico; así como cobre y plata. Sin embargo, muchos de estos elementos forman acceptores profundos y no producen una conducción tipo P significativa a temperatura ambiente.[6]
La movilidad de los electrones del ZnO varía fuertemente con la temperatura y tiene un máximo de ~2000 cm2/(V·s) a 80 K.[44] Los datos sobre la movilidad de los huecos son escasos, con valores que oscilan entre 5 y 30 cm2/(V·s).[45]
Los discos de ZnO, que actúan como varistores, son el material activo en la mayoría de los protectores de sobretensión industriales (pararrayos de óxido metálico).[46][47]
El óxido de zinc destaca por sus propiedades ópticas no lineales, especialmente en estado sólido. La no linealidad de las nanopartículas de ZnO puede ajustarse con precisión en función de su tamaño.[48]
Producción
Para el uso industrial, el ZnO se produce a niveles de 105 toneladas por año[18] mediante tres procesos principales:[17]
Proceso indirecto
En el proceso indirecto o francés, zinc metálico es derretido en un crisol de grafito y vaporizado a temperaturas superiores a los 907 °C (típicamente cercanas a los 1000 °C). El vapor de zinc reacciona con el oxígeno del aire para formar el ZnO, acompañado por un descenso en su temperatura y luminiscencia brillante. Las partículas de óxido de zinc son transportadas a un ducto de enfriamiento y recolectadas en una bolsa. Este método indirecto se popularizó gracias a LeClaire (Francia) en 1844 y por ello es comúnmente conocido como el proceso francés. El producto normalmente consiste de partículas de óxido de zinc aglomeradas con un tamaño promedio de 0.1 a pocos micrómetros. Por el peso, la mayoría del óxido de zinc del mundo es manufacturado mediante el proceso francés.
Proceso directo
El proceso directo o americano empieza con diversos compuestos de zinc contaminados, tales como minerales de zinc o fundiciones de subproductos. Los precursores de zinc son reducidos (reducción carbotérmica) mediante calentamiento con una fuente de carbón como antracita para producir vapor de zinc, el cual es oxidado como en el proceso indirecto. Debido a la baja pureza del material de origen, el producto final también presenta baja calidad en el proceso directo comparada a la del indirecto.
Proceso químico húmedo
Una pequeña cantidad de la producción industrial involucra el proceso químico húmedo, el cual empieza con soluciones acuosas de sales purificadas de zinc, de las que el carbonato de zinc o el hidróxido de zinc es precipitado. Después el precipitado es filtrado, lavado, secado y calcinado a temperaturas de aproximadamente 800 °C.
Síntesis en el laboratorio
Existe un amplio número de métodos especializados para producir ZnO para estudios científicos y diferentes aplicaciones. Estos métodos se pueden clasificar por la forma del ZnO resultante (abultado, película delgada, nanocables), temperatura (“baja” que es cercana a la temperatura ambiente o “alta”, que es T ~ 1000 °C), tipo de proceso (descomposición de vapor o desarrollo de solución) y otros parámetros.
Cristales individuales grandes (muchos centímetros cúbicos) pueden ser desarrollados por transporte de gas (deposición en fase vapor), síntesis hidrotérmica[32][49][50] o por fusión. Sin embargo, debido a la alta presión de vapor del ZnO, producirlo por fusión es problemático. La producción por transporte de gas es difícil de controlar, dejando el método hidrotérmico como el de preferencia. Las películas delgadas pueden ser producidas por deposición química de vapor, epitaxia metal orgánica en fase vapor, electrodeposición, deposición por láser pulsado, pulverización catódica (sputtering), síntesis sol-gel, deposición de capa atómica, atomizador de pirólisis, etc.
El polvo ordinario de óxido de zinc puede ser producido en el laboratorio al electrolizar una solución de bicarbonato de sodio con un ánodo de zinc. El hidróxido de zinc y el gas de hidrógeno son producidos. El hidróxido de zinc al ser calentado se descompone en óxido de zinc.
- Zn + 2 H2O → Zn(OH)2 + H2
- Zn(OH)2 → ZnO + H2O
Nanoestructuras de ZnO
Las nanoestructuras del ZnO pueden ser sintetizadas en una variedad de morfologías incluyendo nano cables, nano bastones, tetrápodos, nano cintas, nano flores, nano partículas, etc. Las nanoestructuras pueden ser obtenidas con varios métodos de síntesis, en ciertas condiciones, y también con el método vapor-líquido-sólido.[32][51]
Las nanoestructuras como barras del ZnO pueden ser producidas por métodos acuosos, los cuales son baratos, escalables y amigables con el ambiente. La producción ocurre a temperaturas relativamente bajas, compatibles con sustratos orgánicos flexibles; no hay necesidad del uso de catalizadores metálicos, y por lo tanto puede ser integrado con tecnologías de silicio bien desarrolladas. Además, existen una variedad de parámetros que pueden ser sintonizados para controlar efectivamente la morfología y las propiedades del producto final. Los métodos químicos húmedos se han mostrado como una técnica poderosa y versátil para producir nanoestructuras de una dimensión de ZnO.[52] La síntesis es típicamente llevada a cabo a temperaturas de cerca de 90 °C, en una solución acuosa equimolar de nitrato de zinc y hexamina, el último proporcionando el entorno básico. Algunos aditivos, como el polietilenglicol o la polietilenimina, pueden mejorar el aspecto de los nano cables de ZnO.[53] El dopaje de los nano cables de ZnO se ha logrado por la adición de otros nitratos metálicos a la solución de producción.[54] La morfología de las nanoestructuras resultantes puede ser sintonizada al cambiar los parámetros relacionados con la composición del precursor (como la concentración de zinc y pH) o al tratamiento térmico (como la temperatura y el ritmo de calentamiento) o al realizar un tratamiento con vapor.[55][56]
Los nano cables de ZnO alineados en silicio pre cimentado, los sustratos cristal y nitruro de galio han sido desarrollados en soluciones acuosas usando sales de zinc acuosas como el nitrato de zinc y el acetato de zinc en ambientes básicos.[57] Los sustratos pre cimentados con ZnO crean sitios para la nucleación homogénea de los cristales de ZnO durante la síntesis. Los métodos comúnmente pre cimentados incluyen descomposición térmica de cristalitos de acetato de zinc, recubrimiento por centrifugación de nano partículas de ZnO y el uso de métodos de disposición física de vapor para depositar el ZnO en delgadas películas.[58][59]
La pre cimentación puede realizarse en conjunción con procedimientos de modelado de arriba hacia abajo tales como la litografía por haz de electrones y la litografía de nano esfera para designar los sitios de nucleación antes del desarrollo. Los nano cables de ZnO alineados pueden ser usados en celdas solares sensibilizadas por colorante y en dispositivos de emisión de campo.[60][61]
Aplicaciones
Las aplicaciones del polvo de óxido de zinc son numerosas, y las principales son resumidas abajo. La mayoría de las aplicaciones explotan la reactividad del óxido como precursor de otros compuestos de zinc. Para aplicaciones en la ciencia material, el óxido de zinc tiene un alto índice de refracción, alta conductividad térmica, propiedades antibacteriales y de protección UV. Por lo tanto, es añadido a materiales y productos incluyendo plásticos, cerámicas, cristales, cemento,[62] caucho, lubricantes,[4] pinturas, ungüentos, adhesivos, selladores, fabricación de hormigón, pigmentos, comidas, baterías, ferritas, retardadores de fuego, etc.[63]
Manufactura de caucho
Entre el 50% y el 60% del ZnO es usado en la industria del caucho.[64] El óxido de Zinc junto con el ácido esteárico es usado en la vulcanización del caucho.[17][65][66] La adición del ZnO también protege al caucho de hongos (ver aplicaciones médicas) y luz UV.
Industria de la cerámica
La industria de la cerámica consume una significativa cantidad de óxido de zinc, en particular el esmalte cerámico y composiciones horneadas. La relativamente alta capacidad calorífica, conductividad térmica y la temperatura de estabilidad del ZnO unido a coeficientes de expansión comparablemente bajos son propiedades deseadas en la producción de cerámicas. El ZnO afecta el punto de fusión y las propiedades ópticas de los barnices, esmaltes, y formulaciones cerámicas. El óxido de Zinc con una expansión baja, el flujo secundario mejora la elasticidad de los barnices al reducir el cambio de viscosidad como función de la temperatura y ayuda a prevenir el cuarteo. Al sustituir ZnO por BaO y PbO, la capacidad calorífica disminuye y la conductividad térmica incrementa. El Zinc en cantidades pequeñas mejora el desarrollo de superficies lustrosas y brillantes. Sin embargo, de cantidades moderadas a altas, produce superficies mate y cristalinas. Con respecto al color, el Zinc tiene una complicada influencia.[64]
Medicina
El óxido de Zinc como una mezcla con cerca de 0,5% de óxido de hierro III (Fe2O3) es llamado calamina y es usado en la loción de calamina. Dos minerales, cincita y hemimorphite, han sido llamados calamina históricamente. Cuando se mezcla con eugenol, un ligando, el óxido de Zinc eugenol es formado, el cual tiene aplicaciones como regenerador y prostodoncia en odontología.[22][67]
Reflexionando las propiedades básicas del ZnO, las partículas finas del óxido tienen propiedades desodorizantes y antibacteriales[68] y es por ello que se agregan a materiales como la fábrica de algodón, caucho, productos de cuidado bucal,[69][70] y empaquetado de comida.[71][72] La acción antibacterial mejorada de las partículas finas comparadas con el material abultado no es exclusivo del ZnO y es observado en otros materiales como la plata.[73] Esta propiedad resulta del incremento del área de superficie de las partículas finas.
El óxido de Zinc es ampliamente usado para tratar una variedad de condiciones en la piel, en productos como polvo para bebés y cremas protectoras para tratar rozaduras, crema de calamina, champús anti caspa, y ungüentos antisépticos.[10][74] Es también un componente en la cinta (llamada “cinta de óxido de cinc”) usada por atletas como vendaje para prevenir daño de tejidos blandos durante sus entrenamientos.[75]
El óxido de Zinc puede ser usado en ungüentos, cremas, y lociones para proteger contra quemaduras por el sol y otros daños a la piel causados por la luz ultravioleta. Tiene el más amplio espectro de reflexión de rayos UVA y UVB que es aprobado para el uso en bloqueadores solares de los Estados Unidos por la Administración de Drogas y Comida (Food and Drug Administration o FDA por sus siglas en inglés),[76] y es completamente fotoestable.[77] Cuando es usado como ingrediente de un bloqueador solar, el óxido de Zinc bloquea ambos los rayos UVA (320-400 nm) y UVB (280-320 nm) de luz ultravioleta. El óxido de Zinc y los otros bloqueadores solares más comunes, dióxido de titanio, son considerados no irritantes, no alergénicos, y no comedogénicos.[78] El Zinc del óxido de Zinc es, sin embargo, ligeramente absorbido por la piel.[79]
Muchos protectores solares usan nano partículas de óxido de Zinc (junto con partículas de dióxido de titanio) pues esas pequeñas partículas no dispersan la luz y por ello no se muestran blancos. Ha habido preocupación pues estos podrían ser absorbidas por la piel.[80][81] Un estudio publicado en 2010 encontró que de 0.23% a 1.31% (promedio de 0.42%) de los niveles de Zinc en la sangre en muestras de sangre venosa podían ser trazas de Zinc de nano partículas de ZnO aplicadas en la piel de los humanos por 5 días, las trazas también se encontraron en muestras de orina.[82] En contraste, una revisión exhaustiva de la literatura médica en el 2011 dijo que no había evidencia de que una absorción sistémica se encontrará en la literatura.[83]
Las nano partículas de óxido de Zinc pueden mejorar la actividad antibacterial de la ciprofloxacina. Se ha demostrado que el ZnO nano que tiene un tamaño promedio de 20 nm y 45 nm puede mejorar la actividad antibacterial de la ciprofloxacina contra Staphylococcus aureus y Escherichia coli in vitro. El efecto de mejoramiento en este nano material es dependiente de la concentración contra todas las cepas examinadas. Este efecto se puede deber a dos razones. La primera, las nano partículas del óxido de Zinc pueden interferir con la proteína NorA, la cual se desarrolla para conferir resistencia en las bacterias y tiene actividad de bombeo que media el eflujo de fluoroquinolones hidrófilos de una célula. La segunda, las nano partículas del óxido de Zinc pueden interferir con la proteína Omf, la cual es responsable de la penetración de quinolones a la célula.[84]
Filtros de cigarros
El óxido de Zinc es un constituyente de los filtros de cigarros. Un filtro que consiste de carbón impregnado con óxido de Zinc y óxido de hierro, remueve cantidades significativas de cianuro de hidrógeno (HCN) y sulfuro de hidrógeno (H2S) del humo de tabaco sin afectar su sabor.[63]
Aditivo de comida
El óxido de Zinc es añadido a muchos productos alimenticios, incluyendo cereales de desayuno, como fuente de cinc,[85] un nutriente necesario (sulfato de zinc también es usado con el mismo propósito). Algunas comidas pre empaquetadas incluyen cantidades traza de ZnO aunque no sea destinado como nutriente.
El óxido de Zinc estaba vinculado a la contaminación de dioxina en cerdos exportados en 2008 en la crisis de cerdo chilena. Se encontró que la contaminación por dioxina se debía a óxido de Zinc usado en el alimento de los cerdos.[86]
Pigmento
El blanco de Zinc es usado como pigmento en pinturas y es más opaco que el litopón, pero menos opaco que el dióxido de titanio.[5] Es también usado como revestimiento para papel. El blanco chino es un grado especial de blanco de Zinc usado en los pigmentos de los artistas. El uso de blanco de Zinc (óxido de cinc) como pigmento en la pintura en óleo empezó a mediados del siglo XVIII.[87] Ha reemplazado al blanco de plomo y fue usado por pintores como Böcklin, Van Gogh,[88] Manet, Munch, entre otros. Es también un ingrediente principal del maquillaje mineral (CI 77947)[89]
Absorbente UV
El micronizado y la nano escala del óxido de Zinc y el dióxido de titanio permite una fuerte protección contra la radiación ultravioleta UVA, y son usados en lociones de bronceado,[90]
así como en lentes de sol con bloqueo UV para uso en el espacio y para protección cuando se realiza una soldadura, siguiendo la investigación de los científicos en el laboratorio Jet Propulsión (JPL ).[91]
Revestimientos
Las pinturas que contienen polvo de óxido de zinc han sido utilizadas como revestimientos anticorrosivos para metales. Son especialmente efectivas para galvanizar el hierro. El hierro es difícil de proteger pues su reactividad con revestidores orgánicos lleva la fragilidad y la falta de adhesión. Las pinturas de óxido de zinc retienen su flexibilidad y adherencia en estas superficies por muchos años.[63]
El ZnO altamente el tipo n dopado con Al, Ga, o In es transparente y conductivo (transparencia ~90%, menos resistividad ~10−4 Ω·cm[92]). Los revestimientos ZnO:Al son utilizados para ventanas que ahorran energía o protegen del calor. El revestimiento deja la parte visible del espectro, pero refleja la radiación infrarroja (IR) dentro del cuarto (ahorro de energía) o no permite a la radiación infrarroja entrar al cuarto (protección del calor), dependiendo en qué lado de la ventana este el revestimiento.[18]
Plásticos, tales como el naftalato de polietileno (PEN), pueden ser protegidos al aplicar un revestimiento de óxido de zinc. El revestimiento reduce la difusión de oxígeno con PEN.[93] Las capas de óxido de zinc pueden ser usadas en policarbonato (PC) en aplicaciones al exterior. El revestimiento protege al PC de la radiación solar y disminuye la velocidad de oxidación y la coloración amarillenta del PC.[94]
Prevención contra la corrosión en reactores nucleares
El óxido de Zinc reducido a 64Zn (el isótopo de Zinc con masa atómica 64) es usado en la prevención de corrosión en reactores nucleares de agua presurizada. La reducción es necesaria pues el 64Zn es transformado en 65Zn radiactivo bajo irradiación por los neutrones del reactor.[95]
Reformado de metano
El óxido de Zinc (ZnO) es utilizado como un paso de pretratamiento para remover el sulfuro de hidrógeno (H2S) del gas natural siguiendo la hidrogenación de cualquier compuesto con azufre antes de un reformado de metano, el cual puede intoxicar al catalizador. A temperaturas entre los 230, H2S se convierte en agua por la siguiente reacción:
- H2S + ZnO → H2O + ZnS
El sulfuro de Zinc (ZnS) se reemplaza con óxido de Zinc fresco cuando el óxido de Zinc ha sido consumado.[96]
Aplicaciones potenciales
Electrónica

El ZnO tiene un amplio y directo “band gap” (3.37 eV o 375 nm a temperatura ambiente). Por esto, sus aplicaciones potenciales más comunes son en diodos láser y diodos emisores de luz (LEDs light emitting diodes).[99] Algunas aplicaciones optoelectrónicas del ZnO se traslapan con las del GaN, el cual tiene un bandgap similar (~3.4 eV a temperatura ambiente). Comparado con el GaN el ZnO tiene más energía de enlace en los excitones (~60 meV, 2.4 veces de la energía térmica a temperatura ambiente), lo que resulta en una emisión brillante a temperatura ambiente del ZnO. El ZnO puede ser combinado con GaN para aplicaciones en LEDs. Por ejemplo, como una capa de óxido conductor transparente y nanoestructuras de ZnO proporcionan un mejor desacoplamiento de luz.[100] Otras propiedades favorables del ZnO en aplicaciones electrónicas incluyen se estabilidad a radiación de alta energía y a químicos húmedos.[101] La resistencia a la radiación[102] hace al ZnO un candidato adecuado para aplicaciones en el espacio. El ZnO es el candidato más prometedor en el campo de los láseres aleatorios para producir una fuente de láser UV de inyección electrónica.
Las puntas de nanorods de ZnO dan como resultado un fuerte aumento de campo eléctrico. Por lo que pueden ser usados como emisores de campo.[103]
Las capas de ZnO dopadas con aluminio son usadas como electrodos transparentes. Los constituyentes Zn y Al son más baratos y menos tóxicos comparados con lo que se usaba generalmente óxido de indio y estaño (ITO). Una aplicación que ha empezado a estar comercialmente disponible es el uso de ZnO como contacto frontal para celdas solares o de pantallas de cristal líquido.[104]
Los transistores de película delgada transparente (TTFT) pueden ser producidos con ZnO. Como transistores de efecto de campo, pueden no necesitar una unión p-n,[105] evitando los problemas del dopaje tipo p del ZnO. Algunos de los transistores e efecto de campo pueden incluso usar nanoros de ZnO como canales de conducción.[106]
Sensor nanorod de óxido de zinc
Los sensores nanorod de óxido de Zinc son dispositivos que detectan cambios en la corriente eléctrica que pasa por nano cables de óxido de Zinc debido a la absorción de moléculas de gas. La selectividad por moléculas de gas de hidrógeno se logró mediante la pulverización catódica de trozos de Pd en la superficie de los nanorod. La adición del Pd parece ser efectiva en la disociación catalítica de las moléculas de hidrógeno en hidrógeno atómico, incrementando la sensibilidad del dispositivo sensor. El sensor detecta concentraciones de hidrógeno menores a 10 partes por millón a temperatura ambiente, de otra forma no hay respuesta del oxígeno.[107][108]
Espintrónica
El ZnO también ha sido considerado por sus aplicaciones en espintrónica: si es dopado con 1-10% de iones magnéticos (Mn, Fe, Co, V, etc.), el ZnO se puede hacer ferromagnético, incluso a temperatura ambiente. Ese ferromagnetismo a temperatura ambiente ha sido observado con la unión ZnO:Mn,[109] pero no es claro aún si se originó de la matriz por sí misma o por fases secundarias de óxido.
Piezoelectricidad
La piezoelectricidad en fibras textiles cubiertas con ZnO han mostrado ser capaces de fabricar “nano sistemas autoalimentados” con el estrés mecánico de cada día del aire o los movimientos del cuerpo.[110][111]
En 2008 el Center for Nanostructure Characterization en el Instituto de Tecnología de Georgia reportó crear un dispositivo que generaba energía (llamado generador de bomba de carga flexible) entregando corrientes alternativas por extensión y liberación de nano cables de óxido de cinc. Este mini generador crea un voltaje que oscila sobre los 45 mili volts, convirtiendo cerca de siete por ciento de la energía mecánica aplicada en electricidad. Los investigadores han usado cables con longitudes de 0.2-0.3 mm y diámetros de tres a cinco micrómetros, pero el dispositivo puede ser escalado a un tamaño más pequeño.[112]
Seguridad
Como aditivo de comida, el óxido de zinc se encuentra en la lista de lo generalmente reconocido como seguro de la FDA, o sustancias GRAS.[113]
El óxido de zinc no es tóxico; sin embargo, es peligroso inhalar los humos del óxido de zinc, que se generan cuando el zinc o las aleaciones de zinc son derretidos y oxidados a altas temperaturas. Este problema ocurre mientras se derrite el latón pues del punto de fusión del latón es cercano al punto de fusión del zinc.[114]
La exposición al óxido de zinc en el aire, que también ocurre con la soldadura de acero galvanizado (chapado de cinc), puede resultar en una enfermedad nerviosa llamada fiebre por humos de metal. Por esta razón, típicamente el acero galvanizado no es soldado, o el zinc se remueve primero.[115]
Véase también
Referencias
- ↑ Número CAS
- ↑ a b c Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (en inglés) (97ma edición). Boca Raton: CRC Press. ISBN 9781498754293.
- ↑ «Zinc oxide». http://www.chemicalbook.com. Consultado el 21 de marzo de 2016.
- ↑ a b c Hernández Battez, A.; González, R.; Viesca, J.L.; Fernández, J.E.; Díaz Fernández, J.M.; Machado, A.; Chou, R.; Riba, J. (31 de julio de 2008). «CuO, ZrO2 and ZnO nanoparticles as antiwear additive in oil lubricants». Wear (En línea) (en inglés) 265 (3-4): 422-428. doi:10.1016/j.wear.2007.11.013.
- ↑ a b c De Liedekerke, Marcel (15 de diciembre de 2006). «2.3. Zinc Oxide (Zinc White): Pigments, Inorganic, 1». Ullmann's Encyclopedia of Industrial Chemistry (En línea) (en inglés). Weinheim: Wiley-VCH. ISBN 9783527306732. doi:10.1002/14356007.a20_243.pub2.
- ↑ a b c d e Özgür, Ü.; Alivov, Ya. I.; Liu, C.; Teke, A.; Reshchikov, M. A.; Doğan, S.; Avrutin, V.; Cho, S.-J. et al. (15 de agosto de 2005). «A comprehensive review of ZnO materials and devices» (PDF). Journal of Applied Physics (en inglés) (Instituto Estadounidense de Física) 98 (4): 1-103. Bibcode:2005JAP....98d1301O. doi:10.1063/1.1992666.
- ↑ Craddock, Paul Terence (31 de agosto de 1998). «Zinc in India» (En línea). 2000 Years of Zinc and Brass (en inglés) (Revised edición). Londres: British Museum Press. p. 27. ISBN 978-0-86159-124-4. Consultado el 28 de junio de 2025.
- ↑ a b Craddock, Paul Terence (18 de septiembre de 2012). «4 Mining and Metallurgy. Part II Primary, Extractive Technologies» (En línea). En Oleson, John Peter, ed. The Oxford Handbook of Engineering and Technology in the Classical World (en inglés). Oxford: Oxford University Press. pp. 93-120. ISBN 9780199940349. doi:10.1093/oxfordhb/9780199734856.013.0005. Consultado el 28 de junio de 2025.
- ↑ Donegan, William L. (2005). «1. History of Breast Cancer» (En línea). En Winchester, David J.; Winchester, David P.; Hudis, C.A. et al., eds. Breast Cancer (Atlas of Clinical Oncology. American Cancer Society) (en inglés) (segunda edición). PMPH-USA. p. 3. ISBN 978-1550092721. Consultado el 28 de junio de 2025. «For early cancers, Galen recommended purging, bleeding, diet and topicals. Ulcerating cancers were treated with caustics or cleansed and treated with zinc oxide.»
- ↑ a b Harding, Fred (2006). «5. The Genesis of Breast Cancer?». Breast Cancer: Cause – Prevention – Cure (en inglés). Aylesbury: Tekline Publishing. p. 83. ISBN 978-0-9554221-0-2. Consultado el 29 de junio de 2025.
- ↑ «Zinc. Properties, Uses & Facts» (En línea). Enciclopedia Británica (en inglés). Encyclopædia Britannica, Inc. 31 de mayo de 2025. Consultado el 29 de junio de 2025.
- ↑ Craddock, Paul Terence (1 de mayo de 2009). «The origins and inspirations of zinc smelting». Journal of Materials Science (en inglés) (Springer) 44 (9): 2181-2191. Bibcode:2009JMatS..44.2181C. doi:10.1007/s10853-008-2942-1.
- ↑ Mookherjee, Asoke (1 de junio de 1964). «The geology of the Zawar lead-zinc mine, Rajasthan, India». Economic Geology (en inglés) (Economic Geology Publishing Company) 59 (4): 656-677. Bibcode:1964EcGeo..59..656M. ISSN 1554-0774. doi:10.2113/gsecongeo.59.4.656. Consultado el 29 de junio de 2025.
- ↑ «Zinc. History, Production, Uses, Properties, Health and Other Facts». General Information of Zinc from the National Institute of Health, WHO, and International Zinc Association (en inglés). Los Ángeles: Los Angeles Chinese Learning Center. 10 de marzo de 2009. Consultado el 29 de junio de 2025.
- ↑ «Zinc White» (en inglés). Nueva Gales del Sur: Matisse Derivan. 1 de marzo de 2020. Archivado desde el original el 2 de abril de 2021. Consultado el 29 de junio de 2025.
- ↑ Douma, Michael (2008). «History of Zinc white» (En línea). Pigments through the Ages (en inglés). Institute for Dynamic Educational Advancement. Consultado el 1 de julio de 2025.
- ↑ a b c d Porter, F. (1991). Zinc Handbook: Properties, Processing, and Use in Design. CRC Press. ISBN 0-8247-8340-9.
- ↑ a b c d Klingshirn, C. (11 de abril de 2007). «ZnO: Material, Physics and Applications». ChemPhysChem (en inglés) (Chemistry Europe) 8 (6): 782-803. doi:10.1002/cphc.200700002. Consultado el 1 de julio de 2025.
- ↑ a b Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederik (11 de octubre de 2001). «XXIII The Zinc Group 1. Zinc and Cadmium» (En línea). Inorganic Chemistry (en inglés) (primera edición). Cambridge (Massachusetts); Berlín: Academic Press; De Gruyter. pp. 1298-1299. ISBN 0-12-352651-5. Consultado el 2 de julio de 2025.
- ↑ a b c Norman Neill Greenwood; Alan Earnshaw (11 de noviembre de 1997). Chemistry of the Elements (en inglés) (segunda edición). Oxford: Butterworth-Heinemann. pp. 1201-1226. ISBN 9780750633659.
- ↑ Nicholson, J. W.; Parker, L. (mayo de 1998). «The chemistry of cements formed between zinc oxide and aqueous zinc chloride». Journal of Materials Science (en inglés) (Springer) 33 (9): 2251-2254. Bibcode:1998JMatS..33.2251N. S2CID 94700819. doi:10.1023/A:1004327018497.
- ↑ a b c Ferracane, Jack L. (2001). Materials in Dentistry: Principles and Applications (en inglés) (segunda edición). Filadelfia: Lippincott Williams & Wilkins. pp. 70, 143. ISBN 0-7817-2733-2. Consultado el 3 de julio de 2025.
- ↑ Park, C.-K.; Silsbee, M.R.; Roy, D.M. (enero de 1998). «Setting Reaction and Resultant Structure of Zinc Phosphate Cement in Various Orthophosphoric Acid Cement-Forming Liquids». Cement and Concrete Research (en inglés) (Elsevier) 28 (1): 141-150. doi:10.1016/S0008-8846(97)00223-8.
- ↑ International Occupational Safety and Health Information Centre (CIS) Accessdate January 25, 2009.
- ↑ Zinc oxide Archivado el 22 de marzo de 2018 en Wayback Machine. MSDS. hazard.com. Accessdate January 25, 2009.
- ↑ Fierro, J.L.G. (23 de agosto de 2005). Metal Oxides: Chemistry & Applications (en inglés) (primera edición). Boca Raton: CRC Press. p. 182. ISBN 9780429113857. doi:10.1201/9781420028126.
- ↑ a b Milošević, Ivanka; Stevanović, Vladan; Tronc, Pierre; Damnjanović, Milan (24 de enero de 2006). «Symmetry of zinc oxide nanostructures». Journal of Physics: Condensed Matter (en inglés) (IOP Publishing) 18 (6): 1939-1953. Bibcode:2006JPCM...18.1939M. ISSN 0953-8984. PMID 21697567. doi:10.1088/0953-8984/18/6/010. Consultado el 8 de julio de 2025.
- ↑ a b James C. Phillips; Gerald Lucovsky (2009). «7. Fundamental Optical Spectra». Bonds and Bands in Semiconductors (en inglés) (segunda edición). Nueva York: Momentum Press. ISBN 978-1-60650-133-7.
- ↑ Bain, Ashim Kumar; Chand, Prem (octubre de 2022). «2. Pyroelectricity». Pyroelectric Materials: Physics and Applications (en inglés) (primera edición). Weinheim: Wiley-VCH. p. 35. ISBN 978-3-527-35101-5. doi:10.1002/9783527839742.
- ↑ Madelung, O.; Rössler, U.; Schulz, M., eds. (1999). «Volume 41B. Semiconductors · II-VI and I-VII Compounds; Semimagnetic Compounds» (En línea). Landolt-Börnstein - Group III: Condensed Matter (en inglés). Springer. ISBN 978-3-540-31359-5. doi:10.1007/b71137. Consultado el 9 de julio de 2025.
- ↑ Klingshirn, Claus Franz; Meyer, Bruno K.; Waag, Andreas; Hoffmann, Axel; Geurts, Johannes M. M. (1 de julio de 2010). «2. Crystal Structure Chemical Binding and Lattice Properties» (En línea). Zinc Oxide: From Fundamental Properties Towards Novel Applications (en inglés). Springer. pp. 9-10. ISBN 978-3-642-10576-0. Consultado el 10 de julio de 2025.
- ↑ a b c Baruah, Sunandan; Dutta, Joydeep (13 de enero de 2009). «Hydrothermal growth of ZnO nanostructures» (PDF). Science and Technology of Advanced Materials (en inglés) (IOP Publishing) 10 (1): 013001. Bibcode:2009STAdM..10a3001B. PMC 5109597. PMID 27877250. doi:10.1088/1468-6996/10/1/013001. Consultado el 10 de julio de 2025.
- ↑ Abdulsattar, Mudar Ahmed (septiembre de 2015). «Capped ZnO (3, 0) nanotubes as building blocks of bare and H passivated wurtzite ZnO nanocrystals». Superlattices and Microstructures (en inglés) (Elsevier) 85: 813-819. Bibcode:2015SuMi...85..813A. ISSN 0749-6036. doi:10.1016/j.spmi.2015.07.015.
- ↑ Millot, Marius; Tena-Zaera, Ramon; Munoz-Sanjose, Vicente; Broto, Jean-Marc; Gonzalez, Jesus (12 de abril de 2010). «Anharmonic effects in ZnO optical phonons probed by Raman spectroscopy». Applied Physics Letters (en inglés) (Instituto Estadounidense de Física) 96 (15): 152103. Bibcode:2010ApPhL..96o2103M. doi:10.1063/1.3387843.
- ↑ Dal Corso, Andrea; Posternak, Michel; Resta, Raffaele; Baldereschi, Alfonso (15 de octubre de 1994). «Ab initio study of piezoelectricity and spontaneous polarization in ZnO». Physical Review B (en inglés) (Sociedad Estadounidense de Física) 50 (15): 10715-10721. Bibcode:1994PhRvB..5010715D. PMID 9975171. doi:10.1103/PhysRevB.50.10715.
- ↑ Voleišis, A.; Kažys, R.; Voleišienė, B.; Sliteris, R. (4 de abril de 2011). «Simultaneous generation of longitudinal and shear ultrasonic waves: knowledge summary, PZT piezoelements manufacturing and experiments» (PDF). Ultragarsas (Ultrasound) (Kaunas: Kauno Technologijos Universitetas/Kaunas University of Technology) 66 (1): 25-31. ISSN 1392-2114. doi:10.5755/j01.u.66.1.263. Consultado el 12 de julio de 2025.
- ↑ Oh, Byeong-Yun; Jeong, Min-Chang; Moon, Tae-Hyoung; Lee, Woong; Myoung, Jae-Min; Hwang, Jeoung-Yeon; Seo, Dae-Shik (15 de junio de 2006). «Transparent conductive Al-doped ZnO films for liquid crystal displays». Journal of Applied Physics (en inglés) (Instituto Estadounidense de Física) 99 (12): 124505-124505-4. Bibcode:2006JAP....99l4505O. doi:10.1063/1.2206417.
- ↑ Perrière, Jacques; Millon, Eric; Craciun, Valentin (6 de marzo de 2006). «12. ZnO and ZnO-Related Compounds» (En línea). En Eason, Robert, ed. Pulsed Laser Deposition of Thin Films: Applications‐Led Growth of Functional Materials (en inglés) (primera edición). Hoboken (Nueva Jersey): John Wiley & Sons. pp. 261-289. ISBN 9780470052129. doi:10.1002/9780470052129.ch12. Consultado el 16 de julio de 2025.
- ↑ Koyama, Miki; Ichimura, Masaya (1 de diciembre de 2019). «Fabrication of ZnO/NiO transparent solar cells by electrochemical deposition». Japanese Journal of Applied Physics (en inglés) (Japan Society of Applied Physics/IOP Publishing) 58 (12): 128003. Bibcode:2019JaJAP..58l8003K. S2CID 209935734. doi:10.7567/1347-4065/ab532a.
- ↑ Look, D. C.; Hemsky, J. W.; Sizelove, J. R. (22 de marzo de 1999). «Residual Native Shallow Donor in ZnO». Physical Review Letters (en inglés) (Sociedad Estadounidense de Física) 82 (12): 2552-2555. Bibcode:1999PhRvL..82.2552L. S2CID 53476471. doi:10.1103/PhysRevLett.82.2552. Consultado el 20 de julio de 2025.
- ↑ Janotti, Anderson; Van de Walle, Chris G. (enero de 2007). «Hydrogen multicentre bonds». Nature Materials (en inglés) (Nature Publishing Group) 6 (1): 44-47. Bibcode:2007NatMa...6...44J. PMID 17143265. doi:10.1038/nmat1795.
- ↑ Kato, Hiroyuki; Sano, Michihiro; Miyamoto, Kazuhiro; Yao, Takafumi (abril de 2002). «Growth and characterization of Ga-doped ZnO layers on a-plane sapphire substrates grown by molecular beam epitaxy». Journal of Crystal Growth (en inglés) (Elsevier). 237-239: 538-543. Bibcode:2002JCrGr.237..538K. doi:10.1016/S0022-0248(01)01972-8. Consultado el 20 de julio de 2025.
- ↑ Ohgaki, Takeshi; Ohashi, Naoki; Sugimura, Shigeaki; Ryoken, Haruki; Sakaguchi, Isao; Adachi, Yutaka; Haneda, Hajime (1 de septiembre de 2008). «Positive Hall coefficients obtained from contact misplacement on evident n-type ZnO films and crystals». Journal of Materials Research (en inglés) (Springer) 23 (9): 2293-2295. Bibcode:2008JMatR..23.2293O. S2CID 137944281. doi:10.1557/JMR.2008.0300.
- ↑ Wagner, P.; Helbig, R. (enero de 1974). «Halleffekt und anisotropie der beweglichkeit der elektronen in ZnO». Journal of Physics and Chemistry of Solids (en alemán) (Elsevier) 35 (3): 327-335. Bibcode:1974JPCS...35..327W. doi:10.1016/S0022-3697(74)80026-0.
- ↑ Ryu, Y. R.; Lee, T. S.; White, H. W. (2003). «Properties of arsenic-doped p-type ZnO grown by hybrid beam deposition». Applied Physics Letters 83: 87. Bibcode:2003ApPhL..83...87R. doi:10.1063/1.1590423.
- ↑ Smeets, René; Janssen, Anton; Peelo, David F.; Sluis, Lou van der; Kapetanovic, Mirsad (30 de julio de 2014). «11.3.3 Mitigation by Surge Arresters» (En línea). Switching in Electrical Transmission and Distribution Systems (en inglés) (primera edición). Chichester: John Wiley & Sons. p. 316. ISBN 1118703634. Consultado el 23 de julio de 2025.
- ↑ Patel, Mukund R. (10 de diciembre de 2012). «9.11 Surge Protection for Small Sensitive Loads» (En línea). Introduction to Electrical Power and Power Electronics (en inglés). Boca Raton: CRC Press. p. 247. ISBN 1466556609. Consultado el 23 de julio de 2025.
- ↑ Irimpan, Litty; Nampoori, V. P. N.; Radhakrishnan, P.; Krishnan, Bindu; Deepthy, A (11 de febrero de 2008). «Size-dependent enhancement of nonlinear optical properties in nanocolloids of ZnO» (PDF). Journal of Applied Physics (en inglés) (Instituto Estadounidense de Física) 103 (3): 033105-1-033105-7. Bibcode:2008JAP...103c3105I. doi:10.1063/1.2838178. Consultado el 23 de julio de 2025.
- ↑ Schulz, D. et al. (2008). «Inductively heated Bridgman method for the growth of zinc oxide single crystals». Journal of Crystal Growth 310 (7–9): 1832. Bibcode:2008JCrGr.310.1832S. doi:10.1016/j.jcrysgro.2007.11.050.
- ↑ Baruah, Sunandan; Thanachayanont, Chanchana; Dutta, Joydeep (2008). «Growth of ZnO nanowires on nonwoven polyethylene fibers». Science and Technology of Advanced Materials (free download) 9 (2): 025009. Bibcode:2008STAdM...9b5009B. doi:10.1088/1468-6996/9/2/025009.
- ↑ Miao, L.; Ieda, Y.; Tanemura, S.; Cao, Y.G.; Tanemura, M.; Hayashi, Y.; Toh, S.; Kaneko, K. (2007). «Synthesis, microstructure and photoluminescence of well-aligned ZnO nanorods on Si substrate». Science and Technology of Advanced Materials (free download) 8 (6): 443. Bibcode:2007STAdM...8..443M. doi:10.1016/j.stam.2007.02.012.
- ↑ Xu, S.; Wang, ZL. (2011). «One-dimensional ZnO nanostructures: Solution growth and functional properties». Nano Res. 4 (11): 1013-1098. doi:10.1007/s12274-011-0160-7.
- ↑ Ying Zhou (2008). «Hydrothermal synthesis of ZnO nanorod arrays with the addition of polyethyleneimine». Materials Research Bulletin 43 (8–9): 2113-2118. doi:10.1016/j.materresbull.2007.09.024.
- ↑ Cui, Jingbiao et al. (2006). «Synthesis and magnetic properties of Co-doped ZnO nanowires». Journal of Applied Physics 99 (8): 08M113. Bibcode:2006JAP....99hM113C. doi:10.1063/1.2169411.
- ↑ Elen, K. et al. (2009). «Hydrothermal synthesis of ZnO nanorods: a statistical determination of the significant parameters in view of reducing the diameter». Nanotechnology 20 (5): 055608. Bibcode:2009Nanot..20e5608E. PMID 19417355. doi:10.1088/0957-4484/20/5/055608.
- ↑ Saghaei, Jaber; Fallahzadeh, Ali; Saghaei, Tayebeh (June 2016). «Vapor treatment as a new method for photocurrent enhancement of UV photodetectors based on ZnO nanorods». Sensors and Actuators A: Physical 247: 150-155. doi:10.1016/j.sna.2016.05.050.
- ↑ Greene; L. E. (2003). «Low-Temperature Wafer-Scale Production of ZnO Nanowire Arrays». Angew. Chem. Int. Ed. 42 (26): 3031-3032. PMID 12851963. doi:10.1002/anie.200351461.
- ↑ Wu, Wan-Yu (2009). «Effects of Seed Layer Characteristics on the Synthesis of ZnO Nanowires». Journal of the American Ceramic Society 92 (11): 2718-2723. doi:10.1111/j.1551-2916.2009.03022.x.
- ↑ Greene, L. E.; Law, M; Tan, DH; Montano, M; Goldberger, J; Somorjai, G; Yang, P (2005). «General Route to Vertical ZnO Nanowire Arrays Using Textured ZnO Seeds». Nano Letters 5 (7): 1231-1236. Bibcode:2005NanoL...5.1231G. PMID 16178216. doi:10.1021/nl050788p.
- ↑ Hua, Guomin (2008). «Fabrication of ZnO nanowire arrays by cycle growth in surfactantless aqueous solution and their applications on dye-sensitized solar cells». Materials Letters 62 (25): 4109-4111. doi:10.1016/j.matlet.2008.06.018.
- ↑ Lee, J.-H. et al. (2009). «Density-controlled growth and field emission property of aligned ZnO nanorod arrays». Appl Phys A 97 (2): 403-408. Bibcode:2009ApPhA..97..403L. doi:10.1007/s00339-009-5226-y.
- ↑ Sanchez-Pescador, R; Brown, JT; Roberts, M; Urdea, MS (11 de febrero de 1988). «The nucleotide sequence of the tetracycline resistance determinant tetM from Ureaplasma urealyticum.». Nucleic Acids Research 16 (3): 1216-7. PMC 334766. PMID 3344217. doi:10.1093/nar/16.3.1216.
- ↑ a b c Nav Bharat Metallic Oxide Industries Pvt. Limited. Applications of ZnO. Archivado el 26 de febrero de 2009 en Wayback Machine. Access date January 25, 2009.
- ↑ a b Moezzi, Amir; McDonagh, Andrew M.; Cortie, Michael B. (2012). «Review: Zinc oxide particles: Synthesis, properties and applications». Chemical Engineering Journal. 185–186: 1-22. doi:10.1016/j.cej.2012.01.076.
- ↑ Brown, H. E. (1957). Zinc Oxide Rediscovered. New York: The New Jersey Zinc Company.
- ↑ Brown, H. E. (1976). Zinc Oxide Properties and Applications. New York: International Lead Zinc Research Organization.
- ↑ van Noort, Richard (2002). Introduction to Dental Materials, 2d Edition. Elsevier Health Sciences. ISBN 0-7234-3215-5.
- ↑ Padmavathy, Nagarajan; Vijayaraghavan, Rajagopalan (2008). «Enhanced bioactivity of ZnO nanoparticles—an antimicrobial study». Science and Technology of Advanced Materials (free download) 9 (3): 035004. Bibcode:2008STAdM...9c5004P. doi:10.1088/1468-6996/9/3/035004.
- ↑ ten Cate, JM (Feb 2013). «Contemporary perspective on the use of fluoride products in caries prevention.». British dental journal 214 (4): 161-7. PMID 23429124. doi:10.1038/sj.bdj.2013.162.
- ↑ Rošin-Grget, K; Peroš, K; Sutej, I; Bašić, K (Nov 2013). «The cariostatic mechanisms of fluoride.». Acta medica academica 42 (2): 179-88. PMID 24308397. doi:10.5644/ama2006-124.85.
- ↑ Li, Qun; Chen, Shui-Lin; Jiang, Wan-Chao (2007). «Durability of nano ZnO antibacterial cotton fabric to sweat». Journal of Applied Polymer Science 103: 412. doi:10.1002/app.24866.
- ↑ Saito, M. (1993). «Antibacterial, Deodorizing, and UV Absorbing Materials Obtained with Zinc Oxide (ZnO) Coated Fabrics». Journal of Industrial Textiles 23 (2): 150. doi:10.1177/152808379302300205.
- ↑ Akhavan, Omid; Ghaderi, Elham (2009). «Enhancement of antibacterial properties of Ag nanorods by electric field». Science and Technology of Advanced Materials (free download) 10: 015003. Bibcode:2009STAdM..10a5003A. doi:10.1088/1468-6996/10/1/015003.
- ↑ British National Formulary (2008). "Section 13.2.2 Barrier Preparations" Archivado el 6 de mayo de 2012 en Wayback Machine..
- ↑ Hughes, G.; McLean, N. R. (1988). «Zinc oxide tape: a useful dressing for the recalcitrant finger-tip and soft-tissue injury» (Free full text). Arch Emerg Med 5 (4): 223-7. PMC 1285538. PMID 3233136. doi:10.1136/emj.5.4.223.
- ↑ «Sunscreen». U.S. Food and Drug Administration.
- ↑ Mitchnick, MA; Fairhurst, D; Pinnell, SR (1999). «Microfine zinc oxide (Z-cote) as a photostable UVA/UVB sunblock agent». Journal of the American Academy of Dermatology 40 (1): 85-90. PMID 9922017. doi:10.1016/S0190-9622(99)70532-3.
- ↑ «What to Look for in a Sunscreen». The New York Times. 10 de junio de 2009.
- ↑ Agren,MS (2009). «Percutaneous absorption of zinc from zinc oxide applied topically to intact skin in man». Dermatologica 1 (1): 36-9. PMID 2307275.
- ↑ «Manufactured Nanomaterials and Sunscreens: Top Reasons for Precaution». 19 de agosto de 2009. Archivado desde el original el 7 de julio de 2010. Consultado el 12 de abril de 2010.
- ↑ «Nano-tech sunscreen presents potential health risk». ABC News. 18 de diciembre de 2008. Consultado el 12 de abril de 2010.
- ↑ Gulson, B.; McCall, M.; Korsch, M.; Gomez, L.; Casey, P.; Oytam, Y.; Taylor, A.; McCulloch, M.; Trotter, J.; Kinsley, L.; Greenoak, G. (2010). «Small Amounts of Zinc from Zinc Oxide Particles in Sunscreens Applied Outdoors Are Absorbed through Human Skin». Toxicological Sciences 118 (1): 140-149. PMID 20705894. doi:10.1093/toxsci/kfq243.
- ↑ Burnett, M. E.; Wang, S. Q. (2011). «Current sunscreen controversies: A critical review». Photodermatology, Photoimmunology & Photomedicine 27 (2): 58-67. PMID 21392107. doi:10.1111/j.1600-0781.2011.00557.x.
- ↑ Banoee, M.; Seif, S.; Nazari, Z. E.; Jafari-Fesharaki, P.; Shahverdi, H. R. (2010). «ZnO nanoparticles enhanced antibacterial activity of ciprofloxacin against Staphylococcus aureus and Escherichia coli». J Biomed Mater Res B Appl Biomater 93 (2): 557-61. PMID 20225250. doi:10.1002/jbm.b.31615.
- ↑ Quaker cereals content. quakeroats.com
- ↑ Kim, Meekyung (8 de enero de 2011). «Formation of polychlorinated dibenzo- p-dioxins/dibenzofurans (PCDD/Fs) from a refinery process for zinc oxide used in feed additives: A source of dioxin contamination in Chilean pork». Chemosphere 82 (9): 1225-1229. PMID 21216436. doi:10.1016/j.chemosphere.2010.12.040.
- ↑ Kuhn, H., Zinc White, in Artists’ Pigments. A Handbook of Their History and Characteristics, Vol. 1, L. Feller, Ed., Cambridge University Press, London 1986, p. 169 – 186
- ↑ Vincent van Gogh, 'Wheatfield with Cypresses, 1889, pigment analysis at ColourLex
- ↑ Bouchez, Colette. «The Lowdown on Mineral Makeup». WebMD. Consultado el 25 de enero de 2009.
- ↑ US Environment Protection Agency: Sunscreen What are the active Ingredients in Sunscreen – Physical Ingredients:"The physical compounds titanium dioxide and zinc oxide reflect, scatter, and absorb both UVA and UVB rays." A table lists them as providing extensive physical protection against UVA and UVB
- ↑ Look Sharp While Seeing Sharp Archivado el 25 de marzo de 2012 en Wayback Machine.. NASA Scientific and Technical Information (2006). Retrieved 17 October 2009. JPL scientists developed UV-protective sunglasses using dyes and "zinc oxide, which absorbs ultraviolet light"
- ↑ Schmidtmende, L; MacManusdriscoll, J (2007). «ZnO – nanostructures, defects, and devices». Materials Today 10 (5): 40. doi:10.1016/S1369-7021(07)70078-0.
- ↑ Guedri-Knani, L. et al. (2004). «Photoprotection of poly(ethylene-naphthalate) by zinc oxide coating». Surface and Coatings Technology. 180–181: 71-75. doi:10.1016/j.surfcoat.2003.10.039.
- ↑ Moustaghfir, A. et al. (2004). «Sputtered zinc oxide coatings: structural study and application to the photoprotection of the polycarbonate». Surface and Coatings Technology. 180–181: 642. doi:10.1016/j.surfcoat.2003.10.109.
- ↑ Cowan, R. L. (2001). «BWR water chemistry?a delicate balance». Nuclear Energy 40 (4): 245. doi:10.1680/nuen.40.4.245.39338.
- ↑ Robinson, Victor S. (1978) "Process for desulfurization using particulate zinc oxide shapes of high surface area and improved strength" Patente USPTO n.º 4128619
- ↑ Liu, X. Y.; Shan, C. X.; Zhu, H.; Li, B. H.; Jiang, M. M.; Yu, S. F.; Shen, D. Z. (2015). «Ultraviolet Lasers Realized via Electrostatic Doping Method». Scientific Reports 5: 13641. PMC 4555170. PMID 26324054. doi:10.1038/srep13641.
- ↑ Zheng, Z. Q.; Yao, J. D.; Wang, B.; Yang, G. W. (2015). «Light-controlling, flexible and transparent ethanol gas sensor based on ZnO nanoparticles for wearable devices». Scientific Reports 5: 11070. PMC 4468465. PMID 26076705. doi:10.1038/srep11070.
- ↑ Bakin, A. et al. (2007). «ZnMgO-ZnO Quantum Wells Embedded in ZnO Nanopillars: Towards Realisation of Nano-LEDs». Physica Status Solidi (c) 4: 158-161. Bibcode:2007PSSCR...4..158B. doi:10.1002/pssc.200673557.
- ↑ Bakin, A. (2010). «ZnO – GaN Hybrid Heterostructures as Potential Cost Efficient LED Technology». IEEE (Invited Paper for a special volume), Proceedings of the IEEE 98 (7): 1281-1287. doi:10.1109/JPROC.2009.2037444.
- ↑ Look, D (2001). «Recent advances in ZnO materials and devices». Materials Science and Engineering B 80: 383. doi:10.1016/S0921-5107(00)00604-8.
- ↑ Kucheyev; S. O. et al. (2003). «Ion-beam-produced structural defects in ZnO». Phys. Rev. B 67 (9): 094115. Bibcode:2003PhRvB..67i4115K. doi:10.1103/PhysRevB.67.094115.
- ↑ Li, Y. B.; Bando, Y.; Golberg, D. (2004). «ZnO nanoneedles with tip surface perturbations: Excellent field emitters». Applied Physics Letters 84 (18): 3603. Bibcode:2004ApPhL..84.3603L. doi:10.1063/1.1738174.
- ↑ Oh, Byeong-Yun; Jeong, Min-Chang; Moon, Tae-Hyoung; Lee, Woong; Myoung, Jae-Min; Hwang, Jeoung-Yeon; Seo, Dae-Shik (2006). «Transparent conductive Al-doped ZnO films for liquid crystal displays». Journal of Applied Physics 99 (12): 124505. Bibcode:2006JAP....99l4505O. doi:10.1063/1.2206417.
- ↑ Nomura, K; Ohta, H; Ueda, K; Kamiya, T; Hirano, M; Hosono, H (2003). «Thin-Film Transistor Fabricated in Single-Crystalline Transparent Oxide Semiconductor». Science 300 (5623): 1269-72. Bibcode:2003Sci...300.1269N. PMID 12764192. doi:10.1126/science.1083212.
- ↑ Heo, Y. W.; Tien, L. C.; Kwon, Y.; Norton, D. P.; Pearton, S. J.; Kang, B. S.; Ren, F. (2004). «Depletion-mode ZnO nanowire field-effect transistor». Applied Physics Letters 85 (12): 2274. Bibcode:2004ApPhL..85.2274H. doi:10.1063/1.1794351.
- ↑ Wang, H. T.; Kang, B. S.; Ren, F.; Tien, L. C.; Sadik, P. W.; Norton, D. P.; Pearton, S. J.; Lin, Jenshan (2005). «Hydrogen-selective sensing at room temperature with ZnO nanorods». Applied Physics Letters 86 (24): 243503. Bibcode:2005ApPhL..86x3503W. doi:10.1063/1.1949707.
- ↑ Tien, L. C.; Sadik, P. W.; Norton, D. P.; Voss, L. F.; Pearton, S. J.; Wang, H. T.; Kang, B. S.; Ren, F.; Jun, J. et al. (2005). «Hydrogen sensing at room temperature with Pt-coated ZnO thin films and nanorods». Applied Physics Letters 87 (22): 222106. Bibcode:2005ApPhL..87v2106T. doi:10.1063/1.2136070.
- ↑ Mofor, A. Che; El-Shaer, A.; Bakin, A.; Waag, A.; Ahlers, H.; Siegner, U.; Sievers, S.; Albrecht, M.; Schoch, W. et al. (2005). «Magnetic property investigations on Mn-doped ZnO Layers on sapphire». Applied Physics Letters 87 (6): 062501. Bibcode:2005ApPhL..87f2501M. doi:10.1063/1.2007864.
- ↑ Keim, Brandon (13 de febrero de 2008). «Piezoelectric Nanowires Turn Fabric Into Power Source». Wired News (CondéNet). Archivado desde el original el 15 de febrero de 2008.
- ↑ Qin, Y; Wang, X; Wang, ZL (2008). «Editor's summary: Nanomaterial: power dresser». Nature 451 (7180): 809-813. Bibcode:2008Natur.451..809Q. PMID 18273015. doi:10.1038/nature06601.
- ↑ «New Small-scale Generator Produces Alternating Current By Stretching Zinc Oxide Wires». Science Daily. 10 de noviembre de 2008.
- ↑ «Database of Select Committee on GRAS Substances (SCOGS) Reviews». Archivado desde el original el 16 de abril de 2014. Consultado el 3 de agosto de 2009.
- ↑ Gray, Theodore. The Safety of Zinc Casting.
- ↑ Calvert, J. B. Zinc and Cadmium Archivado el 27 de agosto de 2006 en Wayback Machine. Last modified August 20, 2007.
Revisiones
- U. Ozgur et al. "A comprehensive review of ZnO materials and devices" (103 pages) J. Appl. Phys. 98 (2005) 041301 doi 10.1063/1.1992666
- A. Bakin and A. Waag "ZnO Epitaxial Growth" (28 pages) Chapter in “Comprehensive Semiconductor Science and Technology“ 6 Volume Encyclopaedia, ELSEVIER, edited by Pallab Bhattacharya, Roberto Fornari and Hiroshi Kamimura, ISBN 978-0-444-53143-8
- S. Baruah and J. Dutta "Hydrothermal growth of ZnO nanostructures" (18 pages) Sci. Technol. Adv. Mater. 10 (2009) 013001 doi 10.1088/1468-6996/10/1/013001 (free download)
- R. Janisch et al. "Transition metal-doped TiO2 and ZnO—present status of the field" (32 pages) J. Phys.: Condens. Matter 17 (2005) R657 doi 10.1088/0953-8984/17/27/R01
- Y.W. Heo et al. "ZnO nanowire growth and devices" (47 pages) Mater. Sci. Eng. R 47 (2004) 1 doi 10.1016/j.mser.2004.09.001
- C. Klingshirn "ZnO: From basics towards applications" (46 pages) Phys. Stat. Solidi (b) 244 (2007) 3027 doi 10.1002/pssb.200743072
- C. Klingshirn "ZnO: Material, Physics and Applications" (21 pages) ChemPhysChem 8 (2007) 782 doi 10.1002/cphc.200700002
- J. G. Lu et al. "Quasi-one-dimensional metal oxide materials—Synthesis, properties and applications" (42 pages) Mater. Sci. Eng. R 52 (2006) 49 doi 10.1016/j.mser.2006.04.002
- S. Xu and Z. L. Wang "One-dimensional ZnO nanostructures: Solution growth and functional properties" (86 pages) Nano Res. 4 (2011) 1013 doi 10.1007/s12274-011-0160-7
- S. Xu and Z. L. Wang "Oxide nanowire arrays for light-emitting diodes and piezoelectric energy harvesters" (28 pages) Pure Appl. Chem. 83 (2011) 2171 doi 10.1351/PAC-CON-11-08-17
Enlaces externos
- Esta obra contiene una traducción parcial derivada de «Zinc oxide» de Wikipedia en inglés, concretamente de esta versión del 2 de junio de 2025, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Zincite properties
- International Chemical Safety Card 0208.
- NIOSH Pocket Guide to Chemical Hazards.
- Zinc white pigment at ColourLex
