Yoduro de germanio (IV)
| Yoduro de germanio | ||
|---|---|---|
 | ||
| General | ||
| Fórmula molecular | GeI4 | |
| Identificadores | ||
| Número CAS | 13450-95-8[1] | |
| ChemSpider | 75317 | |
| PubChem | 83479 | |
| Propiedades físicas | ||
| Densidad | 4320 kg/m³; 4,32 g/cm³ | |
| Masa molar | 581,53907 g/mol | |
| Punto de fusión | 146 °C (419 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El yoduro de germanio (IV) es un compuesto inorgánico con la fórmula química GeI4.
Preparación
El yoduro de germanio (IV) puede obtenerse mediante la reacción del germanio y el yodo o mediante la reacción de dióxido de germanio y ácido yodhídrico al 57%: [2]
- GeO
2 + 4 HI → GeI
4 + 2 H
2O
Propiedades químicas
El yoduro de germanio (IV) reacciona con estaño tetraalquilo a 250 °C para formar R₂SnI₂ y R₂GeI₂ (R = Et, Bu, Ph).[3] Reacciona con germanio y azufre a altas temperaturas para producir GeSI₂ rojo y Ge₂S₃I₂ naranja.[4]
Reacciona con nonacarbonilo de dihierro en un líquido iónico ([BMIm]Cl/AlCl₃) a 130 °C para obtener Ge₁₂[Fe(CO)₃]₈I₄. [5]
- 12 GeI
4 + 15 Fe
2(CO)
9 → Ge
12[Fe(CO)
3]
8I
4 + 22 FeI
2 + 111 CO↑
Propiedades físicas
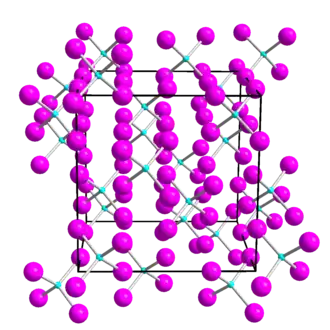
El yoduro de germanio (IV) es un sólido cristalino de color rojo anaranjado que se hidroliza en agua. Es soluble en disulfuro de carbono y benceno, pero menos soluble en tetracloruro de carbono y cloroformo. Comienza a descomponerse en yoduro de germanio (II) y yodo por encima de su punto de fusión.[6] El yoduro de germanio (IV) cristaliza en el sistema cristalino cúbico, grupo espacial Pa3 (grupo espacial n.º 205), con el parámetro de red a = 11,89 Å. La estructura cristalina consiste en moléculas tetraédricas de GeI₄.
Referencias
- ↑ Número CAS
- ↑ A. W. Laubengayer, P. L. Brandt (Feb 1932). «The Preparation of Germanium Tetrabromide and Germanium Tetraiodide». Journal of the American Chemical Society (en inglés) 54 (2): 621-623. ISSN 0002-7863. doi:10.1021/ja01341a502. Archivado desde el original el 20 de octubre de 2021. Consultado el 12 de enero de 2021.
- ↑ Kocheshkov, K. A.; Fomina, N. V.; Sheverdina, N. I.; Zemlyanskii, N. N.; Chernoplekova, V. A. Reaction of tetraalkyltin with germanium tetrahalides. Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya, 1973. 3: 711. ISSN: 0002-3353.
- ↑ A.P. Velmuzhov, M.V. Sukhanov, A.D. Plekhovich, A.I. Suchkov, V.S. Shiryaev (Mar 2015). «Thermal decomposition study of GeSI2 and Ge2S3I2 glassy alloys». Journal of Non-Crystalline Solids (en inglés) 411: 40-44. Bibcode:2015JNCS..411...40V. doi:10.1016/j.jnoncrysol.2014.09.018. Consultado el 12 de enero de 2021.
- ↑ Silke Wolf, Wim Klopper, Claus Feldmann (2018). «Ge 12 {Fe(CO) 3 } 8 (μ-I) 4 : a germanium–iron cluster with Ge 4, Ge 2 and Ge units». Chemical Communications (en inglés) 54 (10): 1217-1220. ISSN 1359-7345. PMID 29336437. doi:10.1039/C7CC08091C. Consultado el 12 de enero de 2021.
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1995). Lehrbuch der anorganischen Chemie (101., verb. und stark erw. Aufl edición). Berlin: de Gruyter. ISBN 978-3-11-012641-9.
Enlaces externos
- Esta obra contiene una traducción derivada de «Germanium(IV) iodide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.