Triterpenoide
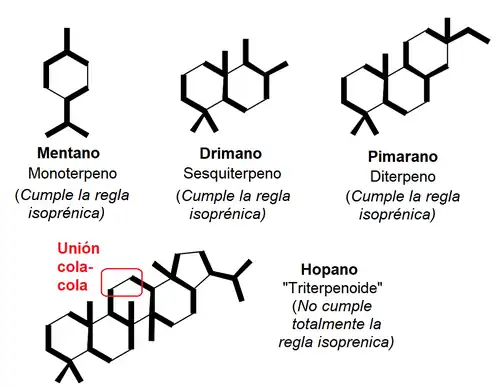
Los triterpenoides constituyen un grupo amplio y diverso de productos naturales derivados del escualeno, ya sea por funcionalización de éste o por sucesivas ciclizaciones. Estos derivados pueden sufrir escisiones oxidativas rompiendo el anillo, insertando oxígeno o perdiendo metilos. Cabe destacar que de acuerdo con la regla del isopreno de Wallack-Ruzicka:[1] "se puede caracterizar un terpeno por uniones de 2-metilbutano (isopreno) unidas por un patrón 'cabeza-cola'; dos isoprenos unidos cabeza-cola conforman una unidad terpénica", Un compuesto constituido por unidades isoprenicas exactamente por esta regla (sin importar si hay otras uniones) son denominados como "terpenos regulares". Esta regla es consistente para los mono-, sesqui- y diterpenos. Sin embargo, los llamados triterpenoides tienen al menos una unión cola-cola. Durante la ciclización, muchos esqueletos transponen ciclos o metilos formando intermediarios que ya no cumplen dicho patrón.
Esto se debe a que los triterpenoides no provienen del pirofosfato de hexaprenilo como ocurre en los terpenos inferiores, sino que provienen de un precursor que se forma por la unión cola-cola del pirofosfato de farnesilo, un triprenol:[2][3]
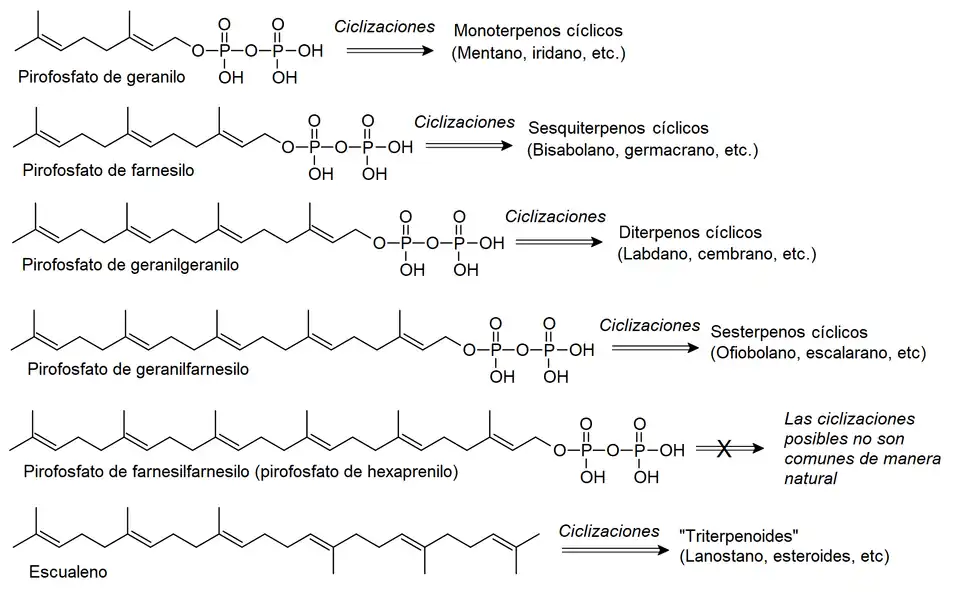
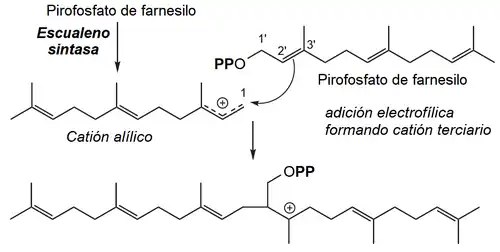
La enzima que cataliza la reacción de conexión cola-cola entre ambos pirofosfatos de farnesilo es la escualeno sintasa (EC 2.5.1.21) por medio del siguiente mecanismo:
- A) Adición electrofílica
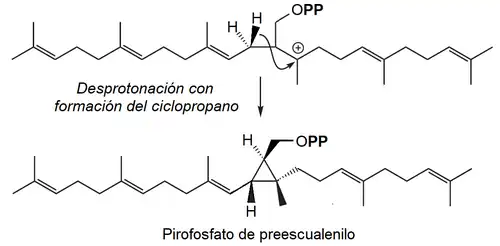
- B) Ciclización con formación del pirofosfato de preescualenilo
- C) Transposiciones
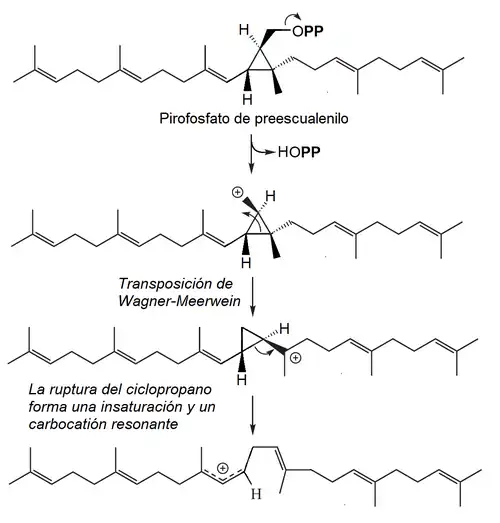
- D) Reducción con NADPH
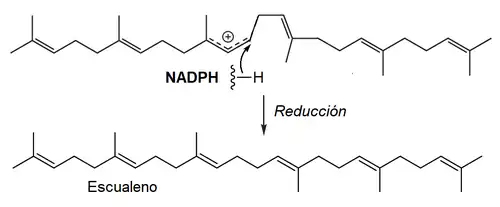
En la síntesis de los triterpenoides eucariontes, el escualeno presenta un paso adicional de epoxidación, catalizado por la escualeno epoxidasa (EC 1.14.13.132):
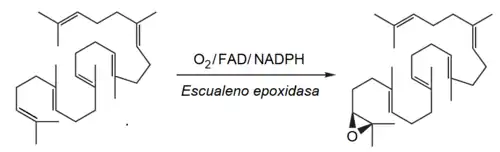
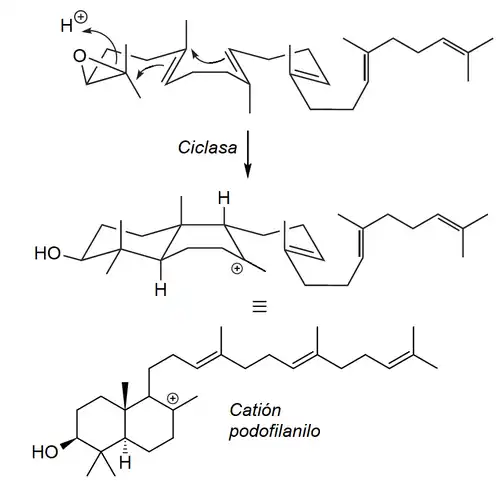
Dependiendo del mecanismo y patrón de ciclización se forman distintos intermediarios:
- Vía polipodano: Se forman sólo dos ciclos, puede ser vía epóxido de escualeno (forma 3-hidroxipolipodanos) o protonación (como en la formación de diterpenos como el labdano)
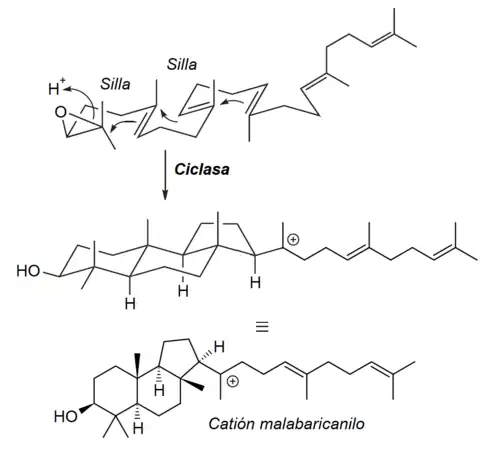
- Vía malabaricano: Sólo se forman tres ciclos y el resto de la cadena queda libre. La enzima más estudiada ha sido la arabidiol sintasa.[4]
- Vía hopanoide: Los hopanoides surgen del escualeno mediante un mecanismo similar de ciclización iniciada por carbocatión, el cual se produce por protonación del carbono 3 del escualeno. Los compuestos derivados tienden a carecer del grupo 3β-hidroxilo característico de la mayoría de los triterpenoides.

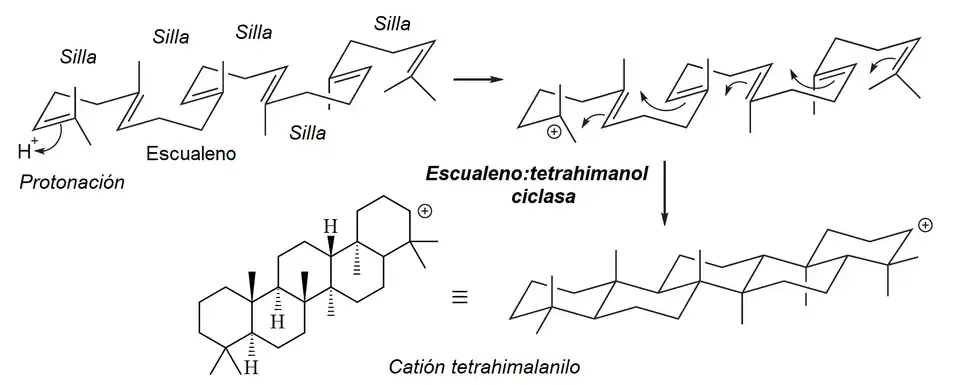
- Vía tetrahimalanoide: Los tetrahimalanoides surgen del escualeno mediante un mecanismo similar de ciclización del hopano, con la diferencia de la formación de un ciclohexano fusionado en lugar de un ciclopentano.
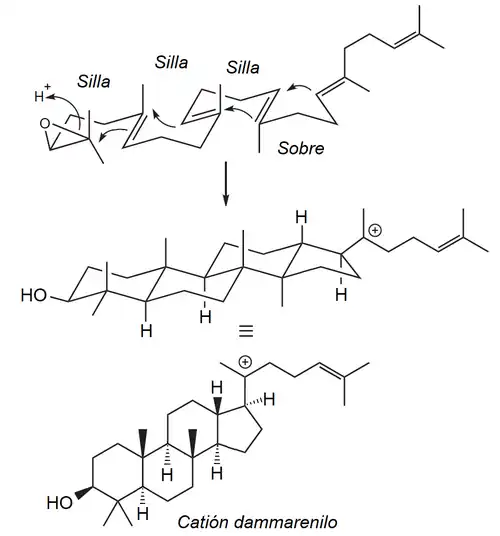
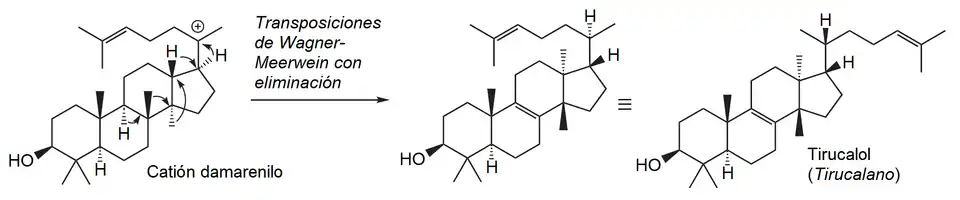
- Vía dammaranoide: Los derivados del dammarano se forman a partir del epóxido de escualeno, el cual promueve la secuencia concertada de ciclizaciones para dar el catión dammarenilo:
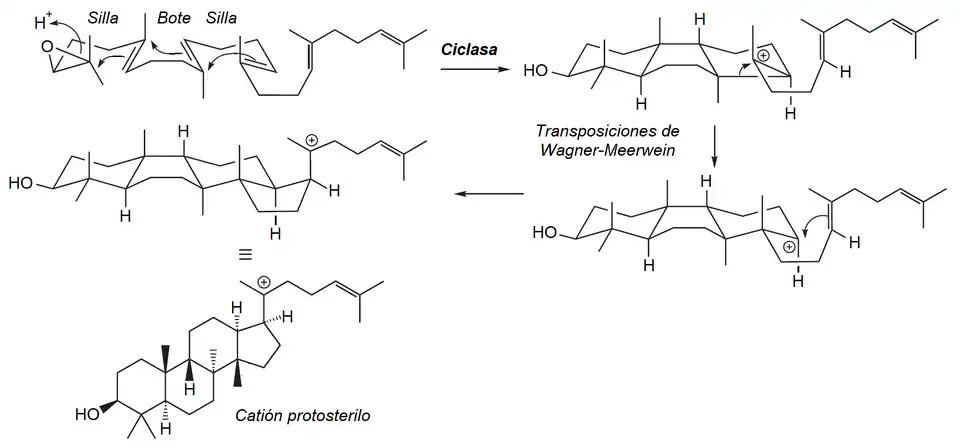
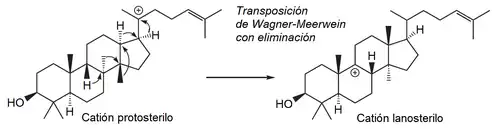
- Vía protosterilo: Los derivados del protosterilo se forman a partir del epóxido de escualeno de manera similar en la que se forma el catión dammarenilo, pero con conformación distinta:
Escualanos
El escualano (NOMBRE IUPAC: 2,6,10,15,19,23-hexametiltetradecano) es un hidrocarburo obtenido de la hidrogenación del escualeno[5] y reportado en el petróleo.[6] Su punto de ebullición es 263 °C, su densidad de 0.81 g/mL y su índice de refracción 1.4530; es utilizado en cosméticos.[7] Se han reportado diversos derivados acíclicos o heterocíclicos del escualano, siendo los más comunes el escualeno y su epóxido. Muchos de estos compuestos se han reportado en algas marinas del género Laurencia,[8][9] Chondria,[10] sus depredadores los caracoles Aplysia[11] y Dolabella[12] así como los hongos Irpex[13] y Daldinia.[14] La numeración mostrada es con respecto a la nomenclatura de productos naturales[15]
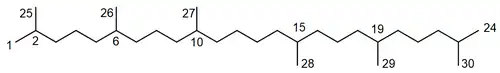 |
 |
| Escualano | Concentricol A |
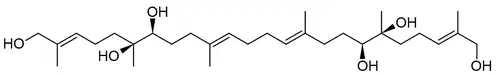
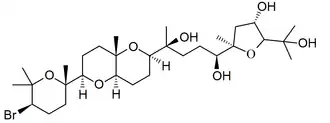 |
 |
| Aplisiol A | Aplysia californica |
Los escualanos de bacterias como Staphylococcus y Pseudomonas son derivados de la escisión oxidativa de carotenos de cadena abierta (Como el ácido diapolicopenedioico[16])
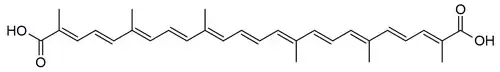
Polipodanos
Malabaricanos
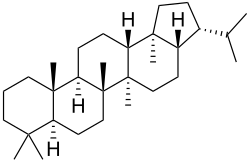
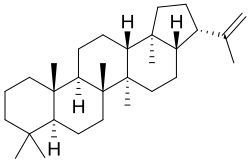
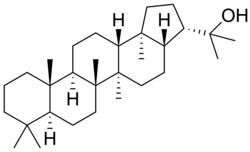
Hopanos
El hopano [NOMBRE IUPAC:(3R,3aS,5aR,5bR,7aS,11aS,11bR,13aR,13bS)-5a,5b,8,8,11a,13b-hexametil-3-(propan-2-il)icosahidro-1H-ciclopenta[a]criseno; nombre trivial de Hopea] es un hidrocarburo (PF 191 °C) aislado de depósitos de shale.[17] Las membranas bacterianas contienen frecuentemente hopanoides (como Rhodomicrobium, Alicyclobacillus o Streptomyces), los cuales parecen sustituir a los esteroles que se encuentran típicamente en las membranas de organismos superiores, lo que ayuda a mantener la integridad estructural y a controlar la permeabilidad.[18]
 |
 |
 |
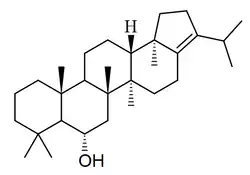 |
| Hopano | Hopeno | Diplopterol | Zeorinina |
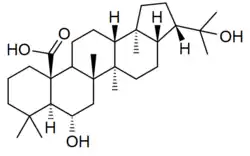
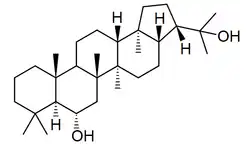
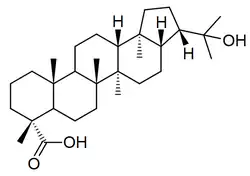
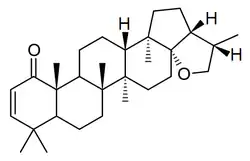
Los hopanoides también son los triterpenos característicos de líquenes (zeorina), como Parmotrema,[19] Pyxine,[20] Physcia (como el ácido aipólico),[21] Peltigera (como el ácido flébico B),[22] Pseudocyphellaria,[23] Parmelia,[24] Diplazium,[25] entre otros:
 |
 |
 |
_i_Skymlag%C3%A5rdens_mark%252C_S%C3%B6rby_sn_2619.jpg) |
| Ácido aipólico | Zeorina | Ácido flébico | Peltigera |
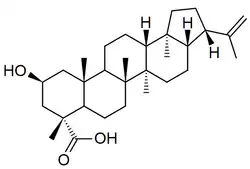
También se ha reportado en helechos como Pyrrosia, Goniophlebium y Dryopteris[26] y plantas angiospermas como Mollugo,[27] Dicranostigma[28] Dipentodon,[29] Hybanthus,[30] Diplazium,[31] entre otras.
 |
 |
 |
 |
| Dicranostigma | Molugogenol B | Ácido drioptérico B | Dryopteris |
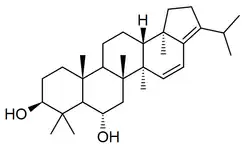
Neohopanos
Los neohopanos [Nombre IUPAC:3a,5a,5b,8,8,11a-hexametil-3-(propan-2-il)icosahidrociclopenta[a]criseno] se han reportado en varias plantas como Crotalaria [32] (como el ácido crotálico), Cyathea,[33] Adiantum[34] (Wallichieneno) y Allangium,[35]
 |
 |
 |
|
| Neohopano | Wallichieneno | Ácido crotálico | Crotalaria |
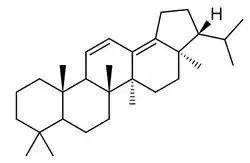
Fernanos
Los fernanos [Nombre IUPAC:3a,5a,8,8,11b,13a-hexametil-3-(propan-2-il)icosahidrociclopenta[a]criseno] es un pequeño grupo de triterpenoides aislados de los helechos Davallia (por ejemplo 7,8-fernadieno) [36] (como el 7,18-fernadieno) y de algunas angiospermas como Euphorbia superba[37] (como la supinenolona E)
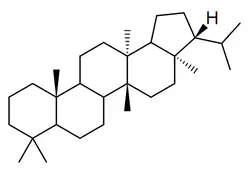 |
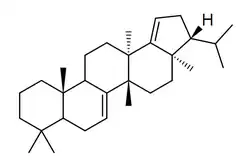 |
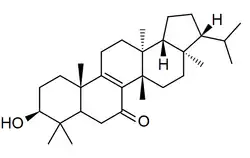 |
 |
| Fernano | 7,18-Fernadieno | Supinenolona E | Davallia |
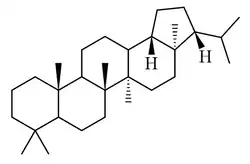
Adiananos
Los adiananos [Nombre IUPAC:3b,5a,8,8,11b,13a-hexametil-3-(propan-2-il)icosahidrociclopenta[a]criseno] fueron aislados de helechos de los géneros Adiantum y Aleuritopteris [38][39][40]
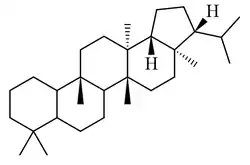 |
 |
|
| Adianano | 5-Adianeno | Adiantum |
Filicano
Los filicanos [Nombre IUPAC:3b,5a,7a,8,11b,13a-hexametil-3-(propan-2-il)icosahidrociclopenta[a]criseno] son triterpenos que también se encuentran en los helechos Davallia, Adiantum, Cyathea[41] y Angiopteris[42]
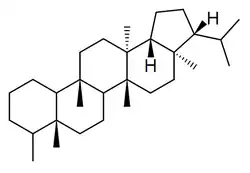 |
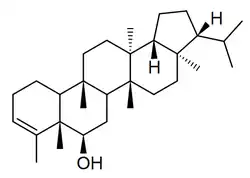 |
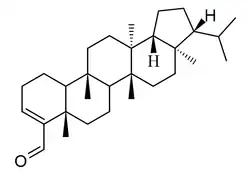 |
 |
| Filicano | Filicenol A | Filicenal | Angiopteris |
Gamacerano (Tetrahimano)
El gamacerano (llamado también tetrahimalano) [Nombre IUPAC:4,4,6a,6b, 9,9,12a,14b-octametildocosahidropiceno] es un alcano aislado del aceite de shale[43] (PF 301 °C). El esqueleto del gammacerano surge del mismo mecanismo de ciclización que el hopanilo. El derivado más notable del gammacerano es el tetrahimenol, un metabolito del protozoario Tetrahymena pyriformis, cuyo sustituyente hidroxilo se deriva de la adición del agua y no del epóxido de escualeno. Otros organismos en los que se han reportado gamaceranos son la bacteria Bradyrhizobium ,[44] Potentilla, la conífera Abies,[45] y la angiospermas Spergula,[46] Oleandra y Acanthus.[47]
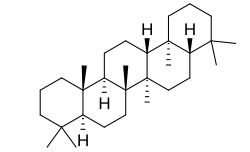 |
 |
 |
| Gamacerano | Tetrahimanol | Tetrahymena |
Poteria anserina produce 28(18→17)-abeogamaceranos llamados poterinásidos A y B [48]
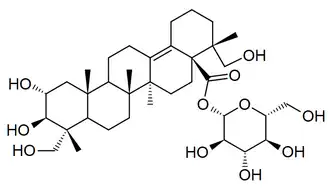
Protostanos y damaranos
Los protostanos y damaranos {Nombre IUPAC: 3a,6,6,9a,11a-pentametil-1-(6-metilheptan-2-il)hexadecahidro-1H-ciclopenta[a]fenantreno} son estereoisómeros entre sí.
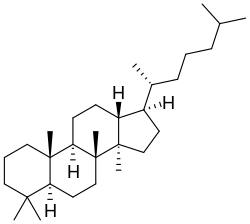 |
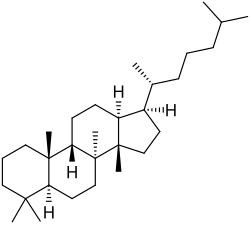 |
 |
 |
| Damarano | Protostano | Panaxatriol | Panax |
Fusidanos
El fusidano {Nombre IUPAC: 3a,3b,6,9a-tetrametil-1-(6-metilheptan-2-il)hexadecahidro-1H-ciclopenta[a]fenantreno} se encuentra presente en compuestos aislados de Fusidium coccineum.
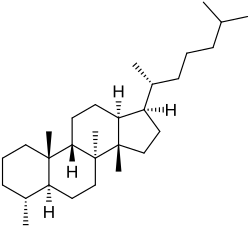 |
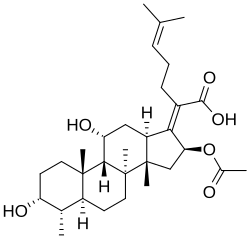 |
| Fusidano | Ácido fusídico |
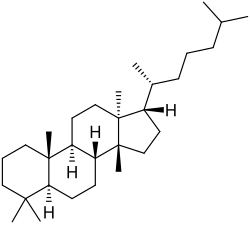
Tirucalanos, eufanos y lanostanos
{Nombre IUPAC: 3a,6,6,9a,11a-pentametil-1-(6-metilheptan-2-il)hexadecahidro-1H-ciclopenta[a]fenantreno}
.png)
El eufol fue aislado del pepino y es un principio activo de varias especies de plantas pertenecientes al género Euphorbia.
 |
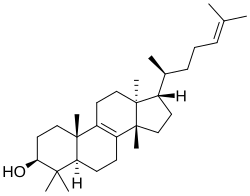 |
 |
| Eufano | Eufol | Euphorbia lactea |
El tirucalol es un alcohol triterpenoide tetracíclico que se encuentra de forma natural en varias especies de plantas, especialmente en el látex de Euphorbia lactea y en la resina de Pistacia lentiscus (lentisco).
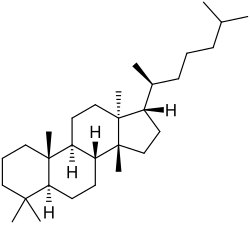 |
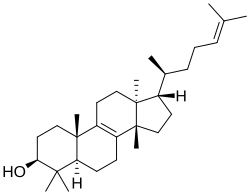 |
| Tirucalano | Tirucalol |
El lanosterol es el precursor de los esteroides animales.
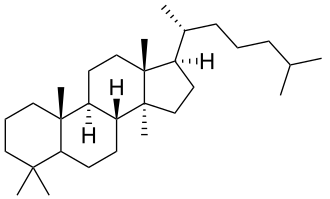 |
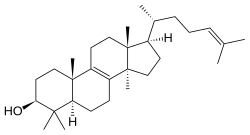 |
| Lanostano | Lanosterol |
Apotirucalanos
{Nombre IUPAC: 3b,6,6,9a,11a-pentametil-1-(6-metilheptan-2-il)hexadecahidro-1H-ciclopenta[a]fenantreno}
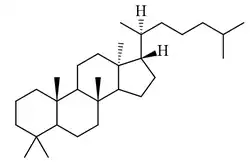 |
 |
 |
| Apotirucalano | Mirrasina | Azadiracnol |
Cicloartano
{Nombre IUPAC: 3a,6,6,12a-Tetrametil-1-(6-metilheptan-2-il)tetradecahidro-1H,10H-ciclopenta[a]ciclopropa[e]fenantreno}
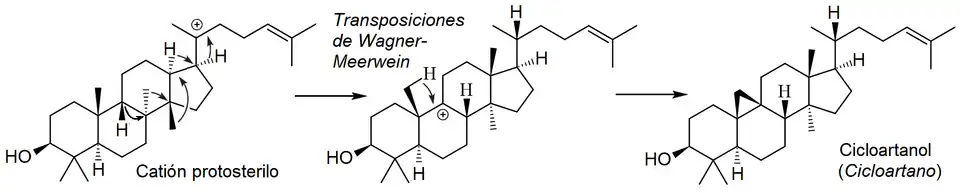
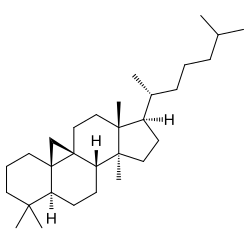 |
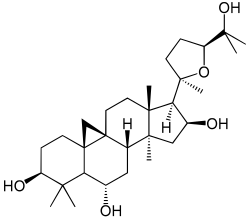 |
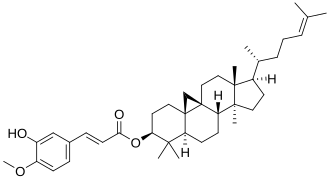 |
| Cicloartano | Cicloastragenol | Orizanol A |
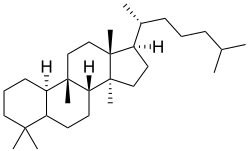
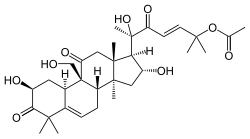
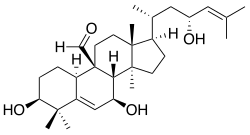
Cucurbitano
{Nombre IUPAC:3a,6,6,9b,11a-Pentametil-1-[6-metilheptan-2-il]hexadecahidro-1H-ciclopenta[a]fenantreno}

 |
 |
 |
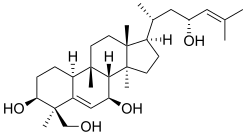 |
| Cucurbitano | Cucurbitacina A | Momordicina I | Balsaminol A |
Bacarano
El bacarano {Nombre IUPAC:} es un hidrocarburo constituyente de sedimentos marinos y aceites minerales, así como en ciertos organismos como Hippophae rhamnoides y Disporum bodinieri.[49][50][51]
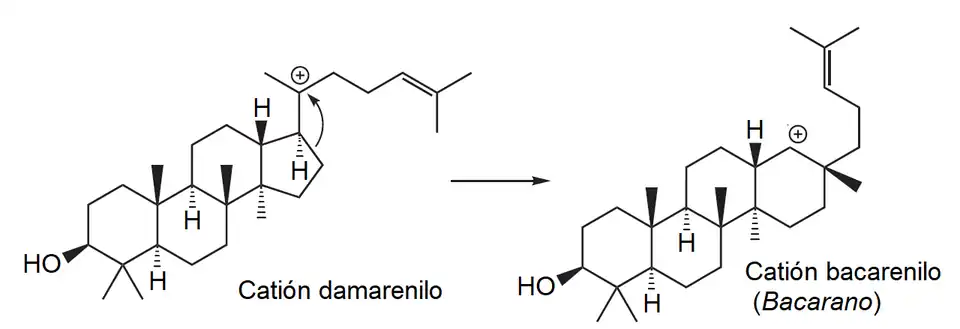
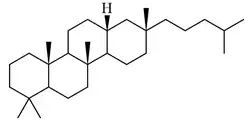 |
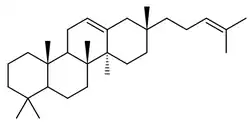 |
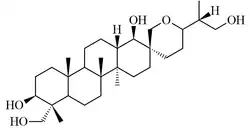 |
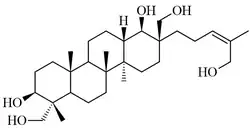 |
| Bacarano | 12,21-Bacaradieno | Hosenkol A | Hosenkol C |
Lupano

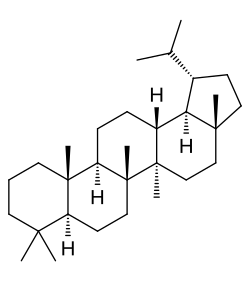 |
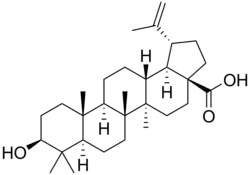 |
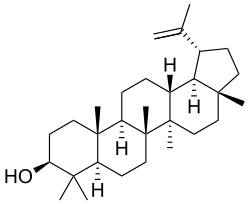 |
| Lupano | Ácido betulínico | Lupeol |
Oleanano
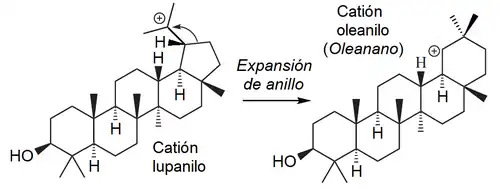
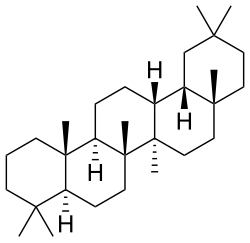 |
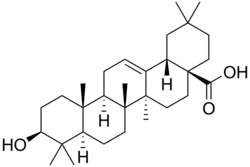 |
| Oleanano | Ácido oleanólico |
Taraxastanos y ursanos
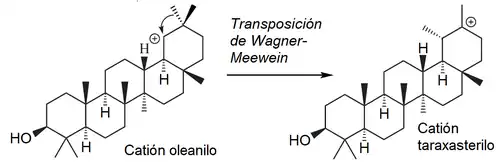
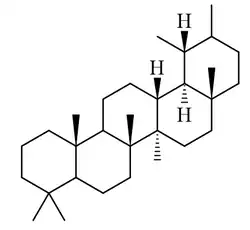 |
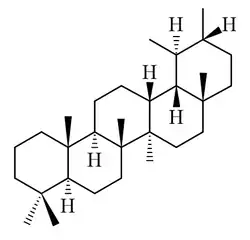 |
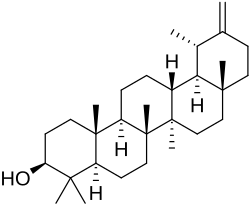 |
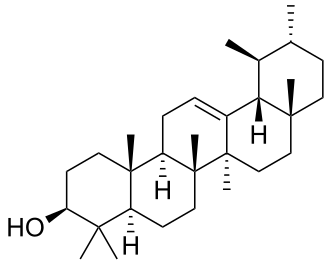 |
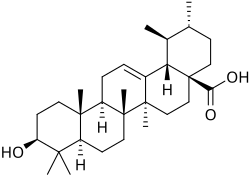 |
| Taraxastano | Ursano | Taraxasterol | α-Amirina | Ácido ursólico |
Abeooleananos
Taraxeranos
Aislado de plantas diversas, tales como Vepris punctata,[52] Neoboutonia macrocalyx,[53] Enkianthus chinensis,[54] Ledum palustre,[55] Sapium discolor[56] (ácidos sapiúmicos) y S.sebiferum (ácido sebiferénico), Maprounea africana,[57] Manniophyton fulvum[58] (Manniotaraxeroles), Hypodaphnis zenkeri[59] (ácido zenkérico), Manihot esculenta[60][61] (maesculetinas, ácidos esculentoicos), Tripterygium regelii[62] (ácido triregeloico), Melanthera elliptica[63] (melanterásidos), Myricaria laxiflora y M. paniculata[64] (miricarinas), Herrania cuatrecasana[65] (herrantiona, herranona), Ficus microcarpa,[66] Saussurea graminea,[67] Euphorbia geniculata[68] (Genicunólidos, euforginol), Marsdenia formosana[69] (Marsformóxidos), Nepeta crassifolia[70] (crasifoato), Portulaca oleracea[71] (ácidos portaraxeroicos), Tamarix chinensis[72] (tamarixenos), Phytolacca acinosa[73] (fitolacanol, acinospesigeninas), Vitex trifolia,[74] Bruguiera cylindrica,[75] Adhatoda vasica[76] (isotaraxerol), Careya arborea[77](careaborina) , entre otros
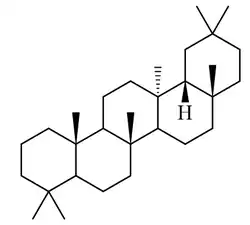 |
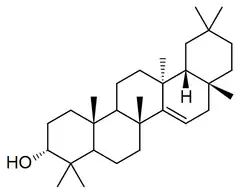 |
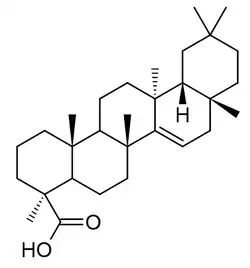 |
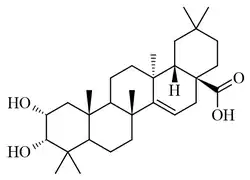 |
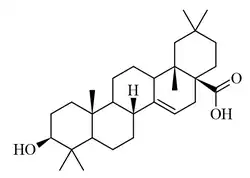
| Taraxerano | Isotaraxerol | Ácido taraxérico | Ácido zenkérico |
 |
 |
 |
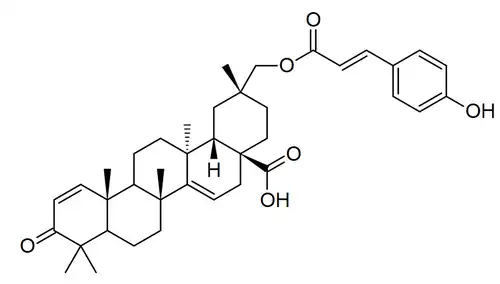
| Ácido sapiúmico E | Fitolacanol | Phytolacca |
Las saponinas del ácido desmetilisoaleuritólico (un 27(13→18)-abeo-26-nortaraxerano), llamados bodinitinas, han sido reportados en la planta Schleffera bodinieri[78]
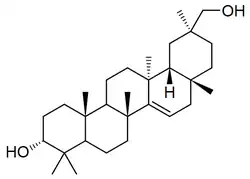
 |
 |
| Ácido desmetilisoaleuritólico | Schefflera |
Multiflorano
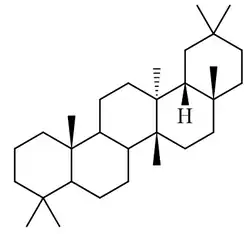
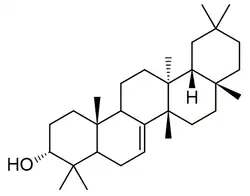
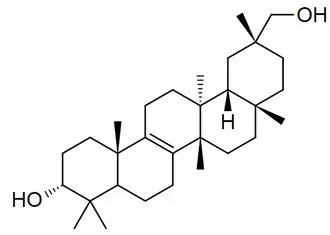
Se ha reportado en plantas Lagenaria siceraria[79] Trichosanthes kirilowii[80] (Karounidiol, isokarounidiol), Bryonia dioica[81] (ácido briocumárico, ácido brioferúlico, ácido brionólico), Cucurbita pepo,[82] Tripterygium wilfordii [83] (ácidos triptocálicos), Luffa cylindrica,[84] Coriaria intermedia,[85] Suregada multiflora[86] (multiflorenol), Cleistocalyx operculatus[87](ácidos cleistocalíxicos), Euphorbia soongarica[88] (Soonoleanona), Sandoricum indicum[89] (ácidos sandorínicos), entre otros
 |
 |
 |
 |
| Multiflorano | Multiflorenol | Brionolol | Trichosanthes |
Glutinano
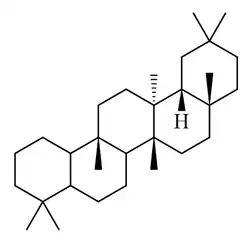 |
| Glutinano |
Friedelano
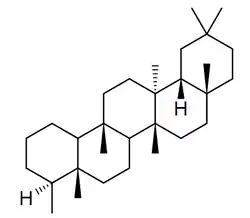 |
| Friedelano |
Paquisanano
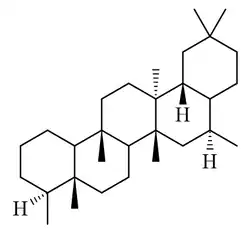 |
| Paquisanano |
Referencias
- ↑ Devlin, T. M. 2004. Bioquímica, 4.ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
- ↑ Julia, M.Y. (1991) Chem. Soc. Rev., 20, 129.
- ↑ Poulter, C.D. et al. (1981) in Biosynthesis of Isoprenoid Compounds, (eds J.W. Porter etal.) Vol. 1, Wiley, New York, p. 413.
- ↑ Stereochemistry of Water Addition in Triterpene Synthesis: The Structure of Arabidiol. Mariya D. K. et al. (2007) Organic Letters. V9 I11.
- ↑ Sax, K.J. et al, Anal. Chem., 1957, 29, 1700-1702
- ↑ Karlsen, D.A. et al, Org. Geochem., 1991, 17, 603-617
- ↑ Gevorgyan, A. et al, ChemPlusChem, 2018, 83, 275-382
- ↑ Cen-Pacheco, F. et al, J. Org. Chem., 2021, 86, 2437-2446
- ↑ Blunt, J.W. et al, Tetrahedron Lett., 1978, 19, 69-72
- ↑ Hamada, T. et al, Nat. Prod. Res., 2021, 35, 5075-5080
- ↑ Manzo, E. et al, Tetrahedron, 2007, 63, 9970-9978
- ↑ Kigoshi, H. et al, Tetrahedron Lett., 2001, 42, 7461-7464
- ↑ Silberborth, S. et al, J. Antibiot., 2000, 53, 1137-1144
- ↑ Stadler, M. et al, Phytochemistry, 2001, 56, 787-793
- ↑ https://iupac.qmul.ac.uk/sectionF/ Rec.02/08/2025
- ↑ Kleinig, H. et al, Z. Naturforsch., C, 1979, 34, 181-185
- ↑ Wardroper, A.M.K. et al, Geochim. Cosmochim. Acta, 1977, 41, 499-510
- ↑ Ourisson, G. et al. (1992) Acc. Chem. Res., 25, 403.
- ↑ Nguyen, T.-Q.-T. et al, Nat. Prod. Res., 2023, 37, 1284-1291
- ↑ Yosioka, I. et al, Chem. Pharm. Bull., 1972, 20, 502
- ↑ Wilkins, A.L. et al, Aust. J. Chem., 1989, 42, 1415
- ↑ Bachelor, F.W. et al, Phytochemistry, 1990, 29,
- ↑ Ronaldson, K.J. et al, Aust. J. Chem., 1978, 31, 215
- ↑ Yosioka, I. et al, Chem. Pharm. Bull., 1966, 14, 804; 1969, 17, 279; 1972, 20, 487
- ↑ Nakanishi, T. et al, Chem. Pharm. Bull., 1995, 43, 2256-2260
- ↑ Lee, J.S. et al, Chem. Pharm. Bull., 2008, 56, 711-714
- ↑ Chakrabarti, P. et al, J. Indian Chem. Soc., 1969, 46, 96
- ↑ Wang, F. et al, J. Asian Nat. Prod. Res., 2010, 12, 94-97
- ↑ Ye, G. et al, Biochem. Syst. Ecol., 2007, 35, 905-908
- ↑ Monnier, M. et al, Biochem. Syst. Ecol., 2012, 42, 10-13
- ↑ Inatomi, Y. et al, Chem. Pharm. Bull., 2000, 48, 1930-1934
- ↑ Ahmed, B. et al, Phytochemistry, 2006, 67, 956-964
- ↑ Arain, Y. et al, Chem. Pharm. Bull., 2003, 51, 1311-1313
- ↑ Ageta, H. et al, Chem. Commun. (London), 1968, 1105-1107
- ↑ Pakrashi, S.C. et al, Tetrahedron Lett., 1971, 12, 365-368
- ↑ Tanaka, Y. et al, Shoyakugaku Zasshi, 1978, 32, 260-266
- ↑ Tanaka, R. et al, Phytochemistry, 1991, 30, 4093
- ↑ Ageta, H. et al, Tetrahedron Lett., 1964, 5, 3413-3418
- ↑ Kamaya, R. et al, Chem. Pharm. Bull., 1996, 44, 690-694
- ↑ Shiojimo, K. et al, Chem. Pharm. Bull., 1997, 45, 639-642
- ↑ Arai, Y. et al, Chem. Pharm. Bull., 1995, 43, 1849-1852
- ↑ Chen, C.-R. et al, Chem. Pharm. Bull., 2010, 58, 408-411
- ↑ Hills, I.R. et al, Chem. Commun. (Londres), 1966, 752-754
- ↑ Bravo, J.-M. et al, Eur. J. Biochem., 2001, 268, 1323-1331
- ↑ Tanaka, R. et al, Phytochemistry, 1992, 31, 3535-3539
- ↑ Hamed, A.I. et al, J. Nat. Prod., 2014, 77, 657-662
- ↑ Anam, E.M., Indian J. Chem., Sect. B, 1997, 36, 110-113
- ↑ Yang, D. et al, J. Org. Chem., 2021, 86, 11220-11236
- ↑ Ge, H. et al, Riyong Huaxue Gongye, 1990, 211-215
- ↑ Poinsot, J. et al, Geochim. Cosmochim. Acta, 1993, 57, 3201-3205
- ↑ Tan, Z. et al, Shizhen Guoyi Guoyao, 2010, 21, 245-247
- ↑ Chaturvedula, V.S.P. et al, J. Nat. Prod., 2004, 67, 895-898
- ↑ Maffo, T. et al, Phytochem. Lett., 2015, 12, 328-331
- ↑ Wang, H.-Q. et al, Bioorg. Chem., 2021, 111, 104866:1-16
- ↑ Zhang, K. et al, Nat. Prod. Res., 2020, 34, 2723-2728
- ↑ Zhang, G.-J. et al, J. Nat. Prod., 2018, 81, 2251-2258
- ↑ Pengsuparp, T. et al, J. Nat. Prod., 1994, 57, 415-418
- ↑ Mbeunkeu, A.B.D. et al, Phytochem. Lett., 2018, 27, 1-8
- ↑ Momo, I.J. et al, Nat. Prod. Res., 2013, 27, 137-145
- ↑ Pan, Y.-M. et al, Phytochem. Lett., 2015, 12, 273-276
- ↑ Chaturvedula, V.S.P. et al, Planta Med., 2003, 69, 271-274
- ↑ Fan, D. et al, Fitoterapia, 2016, 113, 69-73
- ↑ Tagousop, C.N. et al, Phytochem. Lett., 2018, 26, 38-43
- ↑ Zhang, K. et al, Biochem. Syst. Ecol., 2016, 68, 186-191
- ↑ Wiedemann, B. et al, Phytochemistry, 1999, 52, 333-337
- ↑ Chiang, Y.-M. et al, Phytochemistry, 2005, 66, 495-501
- ↑ Hu, J. et al, Fitoterapia, 2012, 83, 55-59
- ↑ Farozi, A. et al, Beilstein J. Org. Chem., 2015, 11, 2707-2712
- ↑ Ito, K. et al, Chem. Pharm. Bull., 1978, 26, 1908-1911
- ↑ Ibrahim, S.A. et al, Turk. J. Chem., 2007, 31, 463-470
- ↑ Mir, S.R. et al, Indian J. Chem., Sect. B, 2016, 55, 119-122
- ↑ Sultanova, N. et al, Planta Med., 2004, 70, 65-67
- ↑ Razdan, T.K. et al, Phytochemistry, 1982, 21, 2339-2342
- ↑ Huang, M.-Y. et al, Helv. Chim. Acta, 2013, 96, 2040-2045
- ↑ Atta-ur-Rahman et al, Nat. Prod. Lett., 1997, 10, 249-256
- ↑ Atta-ur-Rahman et al, Nat. Prod. Lett., 1997, 10, 249-256
- ↑ Talapatra, B. et al, J. Indian Chem. Soc., 1981, 58, 814-815
- ↑ Zhu, M. et al, J. Nat. Prod., 1996, 59, 1043-1046
- ↑ Akiyama, K. et al, Biosci., Biotechnol., Biochem., 2002, 66, 762-769
- ↑ Akihisa, T. et al, Chem. Pharm. Bull., 1994, 42, 1101-1105
- ↑ Hylands, P.J. et al, Phytochemistry, 1979, 18, 1843-1845
- ↑ Appendino, G. et al, Phytochemistry, 1999, 51, 1021-1026
- ↑ Nakano, K. et al, Phytochemistry, 1997, 45, 293-296
- ↑ Biglino, G. et al, Gazz. Chim. Ital., 1969, 99, 830-847
- ↑ Chang, Y.-S. et al, Phytochemistry, 1996, 42, 559
- ↑ Krishnaprasad, A.V. et al, Indian J. Chem., Sect. B, 1983, 22, 610
- ↑ Wang, C. et al, J. Nat. Prod., 2016, 79, 2912-2923
- ↑ Gao, J. et al, J. Nat. Prod., 2017, 80, 1767-1775
- ↑ Tanaka, T. et al, J. Nat. Prod., 2001, 64, 1243-1245
Enlaces externos
- Esta obra contiene una traducción derivada de «Triterpenoid» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.