Tris(trimetilsilil)fosfina
| Tris(trimetilsilil)fosfina | ||
|---|---|---|
3.png) | ||
| Nombre IUPAC | ||
| Tris(trimetilsilil)fosfano | ||
| General | ||
| Fórmula estructural | (H3C)3Si3P | |
| Fórmula molecular | C9H27PSi3 | |
| Identificadores | ||
| Número CAS | 15573-38-3[1] | |
| ChemSpider | 239909 | |
| PubChem | 272683 | |
| UNII | Y6TG7WF7OQ | |
|
C[Si](C)(C)P([Si](C)(C)C)[Si](C)(C)C
| ||
| Propiedades físicas | ||
| Densidad | 863 kg/m³; 0,863 g/cm³ | |
| Masa molar | 250,54 g/mol | |
| Punto de fusión | 24 °C (297 K) | |
| Punto de ebullición | 102/105 °C (375/378 K) | |
| Índice de refracción (nD) | 1.502 | |
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La tris(trimetilsilil)fosfina es un compuesto organofosforado con la fórmula P(SiMe3)3 (Me = metilo). Es un líquido incoloro que se enciende en el aire y se hidroliza fácilmente.[2]
Síntesis
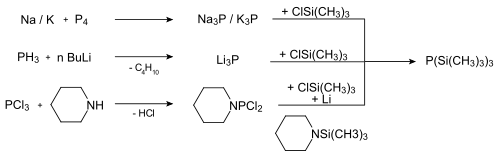
La tris(trimetilsilil)fosfina se prepara principalmente tratando cloruro de trimetilsililo con fósforo blanco y una aleación de sodio y potasio:[3]
- 1/4 P4 + 3 Me3SiCl + 3 K → P(SiMe3)3 + 3 KCl
Existen otros métodos, pero los 3 principales son:[2]
Las dos primeras vías de síntesis son técnicamente factibles, pero menos adecuadas para el uso diario en el laboratorio.
Reacciones
La tris(trimetilsilil)fosfina se utiliza a menudo como un bloque de construcción sintético para la extensión de moléculas existentes mediante un grupo fosfina. Los grupos trimetilsililo sólo sirven temporalmente para la protección y aumentan la nucleofilia del fósforo. La fácil eliminación de los grupos protectores está garantizada por la elevada oxofilicidad (afinidad del silicio por el oxígeno).
El compuesto se hidroliza para dar fosfina:
- P(SiMe3)3 + 3 H2O → PH3 + 3 HOSiMe3
El tratamiento de ciertos cloruros de acilo con tris(trimetilsilil)fosfina produce fosfaalquinos, un ejemplo de los cuales es el terc-butilfosfaacetileno.[4]

Síntesis de un fosfaalquino utilizando tris(trimetilsilil)fosfina.
La reacción con terc-butóxido de potasio escinde un enlace P-Si, dando lugar a la sal de fosfuro:[5]
- P(SiMe3)3 + KO-t-Bu → KP(SiMe3)2 + Me3SiO-t-Bu
Es un reactivo en la preparación de clústeres de fosfuro metálico por reacción con haluros metálicos o carboxilatos. En tales reacciones se libera el haluro de sililo o el carboxilato de sililo como se ilustra en esta reacción idealizada:
- P(SiMe3)3 + 3 CuCl → Cu3P + 3 ClSiMe3

Seguridad
La tris(trimetilsilil)fosfina se enciende espontáneamente en el aire, por lo que se manipula utilizando técnicas libres de aire.
Referencias
- ↑ Número CAS
- ↑ a b «Tris(trimethylsilyl)phosphine». Handbook of Reagents for Organic Synthesis. Reagents for Silicon-Mediated Organic Synthesis. 2011. pp. 422-427. ISBN 978-0-471-93623-7. doi:10.1002/047084289X.rn01332.
- ↑ Becker, Gerd; Schmidt, Helmut; Uhl, Gudrun; Uhl, Werner (1990). «Tris(Trimethylsilyl)Phosphine and Lithium Bis(Trimethylsilyl)Phosphide.Bis-(Tetrahydrofuran)». Inorganic Syntheses 27. pp. 243-9. ISBN 978-0-470-13258-6. doi:10.1002/9780470132586.ch48.
- ↑ M. Regitz (1990). «Phosphaalkynes: new building blocks in synthetic chemistry». Chem. Rev. 90: 191-213. doi:10.1021/cr00099a007..
- ↑ Russell, Christopher A.; Townsend, Nell S. (2012). «Phosphaalkynes». En Kamer, Paul C. J.; Van Leeuwen, Piet W. N. M, eds. Phosphorus(III) Ligands in Homogeneous Catalysis. Wiley-VCH. pp. 343-354. ISBN 978-1-118-29971-5. doi:10.1002/9781118299715.ch11.
- ↑ Fenske, D.; Holstein, W. (1994). «[Cu96P30{P(SiMe3)2}6(PEt3)18], a New Phosphorus-Bridged Copper Cluster». Angew. Chem. Int ed. Engl. 33 (12): 1290-1292. doi:10.1002/anie.199412901.