Trióxido de dibromo
| Trióxido de dibromo | ||
|---|---|---|
| Nombre IUPAC | ||
| Trióxido de dibromo | ||
| General | ||
| Otros nombres | Óxido de bromo(III); Anhídrido bromoso | |
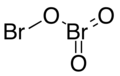
| Fórmula estructural |
 | |
| Fórmula molecular |
Br 2O 3 | |
| Identificadores | ||
| Número CAS | 53809-75-9[1] | |
| ChemSpider | 11564402 | |
| PubChem | 15779614 | |
|
BrO[Br](=O)=O
| ||
| Propiedades físicas | ||
| Masa molar | 207,81 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El trióxido de dibromo, también óxido de bromo(III) o anhídrido bromoso, es un compuesto químico binario formado por la combinación de bromo y oxígeno y con la fórmula Br2O3. A bajas temperaturas se presenta como un sólido estable de color anaranjado que descompone a temperaturas superiores a −40 °C. Tiene la estructura Br−O−BrO2.[2] El ángulo de enlace de Br−O−Br es de 111,7°, el ángulo de enlace de O−Br=O es de 103,1° y el ángulo de enlace de O=Br=O es de 107,6°. La longitud de enlace de Br−OBrO2 es de 1,845 Å (0,184 nm), la de O−BrO2 es de 1,855 Å (0,186 nm) y la de Br=O es de 1,612 Å (0,161nm).[3]
Reacciones
El trióxido de dibromo se puede preparar haciendo reaccionar una solución de bromo en diclorometano con ozono a bajas temperaturas.[2][4] En disolución alcalina es inestable, dismutando a bromuro y bromato.[4]
Véase también
Referencias
- ↑ Número CAS
- ↑ a b Henderson, K. M. Mackay; R. A. Mackay; W. (2002). Introduction to modern inorganic chemistry (6th edición). Cheltenham: Nelson Thornes. ISBN 9780748764204.
- ↑ Jansen, Martin; Kraft, Thorsten (1997). «The Structural Chemistry of Binary Halogen Oxides in the Solid State». Chemische Berichte (Wiley) 130 (3): 307-316. ISSN 0009-2940. doi:10.1002/cber.19971300302.
- ↑ a b Wiberg, Egon (2001). Wiberg, Nils, ed. Inorganic chemistry (1st edición). San Diego, Calif.: Academic Press. p. 464. ISBN 9780123526519.