Trampas extracelulares de neutrófilos
Las NETs (trampas extracelulares de neutrófilos) son estructuras clave del sistema inmunitario innato, formadas por ADN, histonas y proteínas que los neutrófilos liberan en un proceso llamado NETosis. Estas cadenas reticulares extracelulares tienen como función principal atrapar y neutralizar microorganismos, impidiendo su propagación y concentrando agentes antimicrobianos en su entorno. Este mecanismo permite eliminar los patógenos con eficacia, minimizando el daño a las células del huésped.
Además de su papel protector, las NETs están implicadas en diversos procesos patológicos, incluidos trastornos autoinmunes como el lupus eritematoso sistémico, la artritis reumatoide y la psoriasis, así como en enfermedades no infecciosas como la diabetes o el cáncer.[1][2][3]
Se ha observado que las NETs también contienen proteínas antimicrobianas específicas, como la mieloperoxidasa, la elastasa o la lactoferrina, que potencian su acción microbicida. Estas trampas pueden inmovilizar una gran variedad de patógenos, incluyendo bacterias, hongos y parásitos, e incluso se ha sugerido que ayudan a eliminar estructuras de gran tamaño, como las hifas fúngicas, que no pueden ser fagocitadas. También se ha documentado que otras células como eosinófilos y mastocitos pueden generar trampas extracelulares similares, aunque se trata de una característica predominante en neutrófilos.[4]
Estructura y composición
Las NETs están formadas por:
- Histonas H2A, H2B, H3 y H4
- Cromatina descondensada: estructura física de la red extracelular donde quedarán atrapados los microorganismos.
- Proteínas granulares de los neutrófilos: se encuentran dentro de los gránulos de los neutrófilos y tienen actividad antimicrobiana.
- Elastasa de neutrófilos (NE): serinoproteasa. Participa en la degradación de la matriz extracelular y en la descondensación de la cromatina durante la NETosis.
- Mieloperoxidasa (MPO): enzima oxidativo. Genera especies reactivas de oxígeno (ROS) y ayuda en la descondensación de la cromatina.
- Proteinasa 3 (PR3): proteasa. Presenta actividad antimicrobiana directa.
- Proteínas citosólicas.
- Calprotectina: complejo de dos proteínas (S100A8/S100A9) que actúa como agente secuestrador de nutrientes. Tiene actividad antimicrobiana, ya que quelata metales esenciales para la supervivencia bacteriana.
- Lactoferrina: inhibe el crecimiento bacteriano retirando el hierro necesario para la supervivencia de las bacterias.
Cabe destacar que la composición de las NETs varía según el estímulo utilizado, ya que se han identificado 330 proteínas presentes en su composición, pero solo 74 están presentes en todas las condiciones.[5]
Funciones de las NETs
- Captura y eliminación de patógenos: las proteínas presentes en las NETs (NE, PR3, CG, etc.) tienen actividad antiviral y pueden mitigar eficazmente al agente patógeno en concentraciones que no afectan a la célula huésped.[2]
- Presentación de autoantígenos: en el caso de enfermedades autoinmunes, las NETs exponen componentes nucleares y citoplasmáticos que pueden dar lugar a la producción de autoanticuerpos.
- Participación en procesos de trombosis: las NETs pueden activar plaquetas y factores de coagulación que favorecen la formación de trombos.
- Modulación de la respuesta inmunitaria: interacción de las NETs con células inmunitarias que permite amplificar o mitigar su acción.
NETosi
El concepto de NETosis surgió gracias a Steinberg y Grinstein en el año 2007. Este término hace referencia al proceso inmunológico mediante el cual los neutrófilos liberan trampas extracelulares (NETs) para capturar y destruir patógenos. A pesar de esta primera definición de NETosis, actualmente se han descrito varios tipos de NETosis.[6]
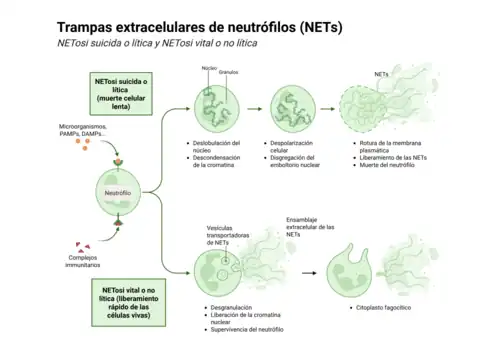
En primer lugar, la NETosis suicida, también conocida como NETosis lítica o dependiente de la NADPH oxidasa, implica la muerte del neutrófilo tras la liberación de las NETs. Este proceso comienza con la descondensación de la cromatina, la delobulación nuclear, la pérdida del envoltorio celular y la despolarización de la célula, y finalmente la rotura de la membrana plasmática, lo que conlleva la muerte del neutrófilo. En este caso, la muerte por NETosis se caracteriza por la pérdida de las membranas intracelulares antes de que se pierda la integridad de la membrana plasmática.[8]
Por otro lado, la NETosis vital es una forma no lítica de NETosis que implica la expulsión de cromatina y la liberación de gránulos proteicos, sin que ello conlleve la muerte celular.[9]
La NETosis mitocondrial, en cambio, es un proceso rápido, no letal y regulado por ROS, que implica canales de potasio, SIRT1 y OPA1.[10]
Por lo tanto, en términos generales, la NETosis es el proceso mediante el cual los neutrófilos dan lugar a la liberación de cromatina y proteínas, con o sin muerte celular, ampliando así la definición inicial del concepto.
Se han identificado múltiples inductores fisiológicos de este proceso celular, entre ellos infecciones bacterianas, fúngicas, parasitarias y víricas, como el VIH, entre otras. Por otro lado, especies reactivas de oxígeno como el peróxido de hidrógeno, la formación del complejo antígeno-anticuerpo (Ag-Ac) o el LPS también pueden inducir la muerte por NETosis.
Cambios morfológicos en la Netosis
Para llevar a cabo la liberación de NET, los neutrófilos sufrirán cambios morfológicos, allanándose y adhiriéndose al sustrato. Posteriormente la cromatina se descondesará, el núcleo perderá su estructura lobular y las membranas interna y externa se desprenderán una de otra mientras los gránulos se desintegran.[11]
Pasada una hora, la envoltura nuclear se disgregará en forma de vesículas y el nucleoplasma y el citoplasma formarán una masa homogénea.
Por último, las células adquiriran una forma redondeada y se contraerán rompiendo la membrana de la célula y su contenido será liberado formando las NETs. Sin embargo, las NETs se pueden liberar sin que la célula rompa la membrana plasmática.
Vía de activación de la Netosis
La activación de la vía de la NETosis depende del ROS generado por la NADPH oxidasa.[7]
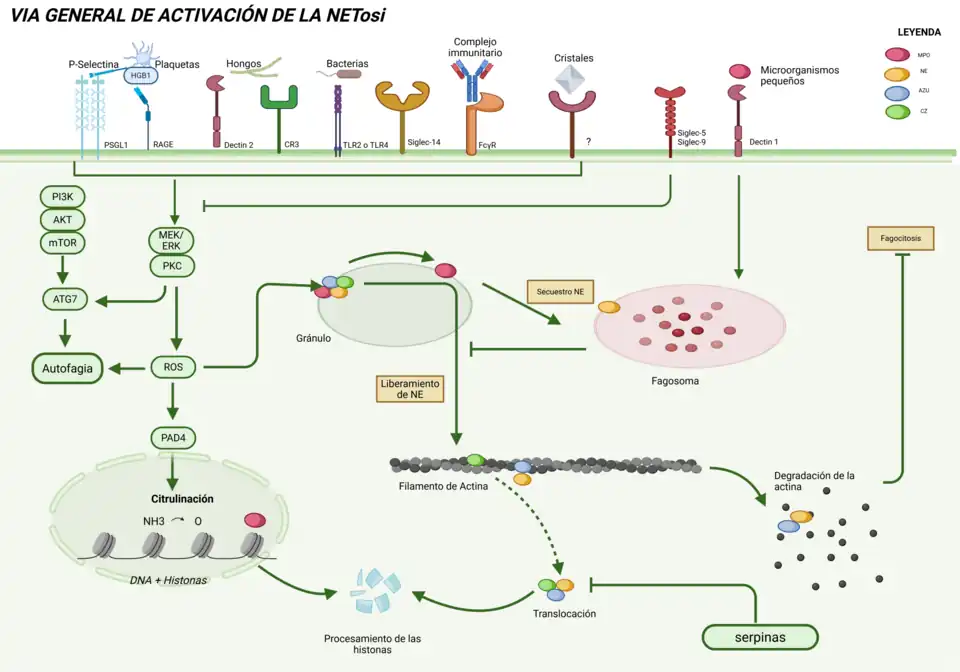
Este proceso es iniciado por la unión de ligandos como microorganismos, estímulos endógenos, PAMPS, complejos inmunitarios entre otros, a sus correspondientes receptores situados en la membrana plasmática. Esto conlleva la activación de estos que a su vez activan una serie de quinasas como la MEK (MAPK/ERK quinasa), la proteína-cinasa C (PKC), la fosfoinosítidol 3 - cinasa (PI3K) y la proteína-cinasa B (AKT). Sin embargo, los mecanismos de activación de NADPH oxidasa para la formación de ROS no se conocen prácticamente. El principal mecanismo conocido por el que se activa la NADPH oxidasa está asociado a la fosforilación de sus subunidades mediante la proteína quinasa C (PKC) junto con otras quinasas como Raf, AKT, MEK y ERK en el caso de infecciones causadas por Helicobacter pylori o Entamoeba histolytica hecho que conlleva que la enzima se transloque a la membrana tal y como hemos comentado previamente. La cascada de señalización Raf-MEK-ERK así como la PKC estimulan la expresión de Mcl-1, la principal proteína antiapoptótica de los neutrófilos.[12]
Se ha podido observar que la PI3K está implicada en la autofagia y los neutrófilos que no presenten la proteína ATG7 liberan menos NET. Así mismo se conoce que ROS induce autofagia[13]
La NADPH oxidasa genera ROS y activa una mieloperoxidasa (MPO) que conduce a la activación y consiguiente translocación de elastasa (NE) desde los gránulos azurófilos del citosol hasta el núcleo del neutrófilo. Asimismo, se da la degradación del citoesqueleto de actina para bloquear la fagocitosis. Esto implica que las dos proteínas causen la proteólisis de las histonas y la descondensación de la cromatina.[7]
Otra proteína que parece ser importante en la NETosis es la proteína DEK, la cual se piensa que podría tener una función similar a la proteína MPO en la descondensación de la cromatina. Cabe destacar que la NETosis es defectuosa en los neutrófilos de pacientes con síndrome de Papillon-Lefèvre, causado por mutaciones en la cisteína proteasa catepsina C (CTSC), que procesa la NE a su forma madura, lo cual lleva a pensar que la NE es una proteína que desempeña un papel importante en la activación de la NETosis.[7]
La proteína arginina deiminasa tipo 4 (PAD4) es una enzima nuclear que citrulina los residuos de arginina de las histonas, convirtiendo los grupos amina en cetonas. Esto supone una modificación en la cromatina que implica su descondensación.[14] Se para que PAD4 pueda actuar correctamente, se necesita un ambiente reducto, sin embargo, la inhibición de la NADPH oxidasa disminuye su actividad, y se ha observado que mediante peróxido de hidrógeno y calcio (activado por PKC), esta enzima se activa. Esto ha llevado a concluir que la acción de PAD4 probablemente ocurre posteriormente a la señalización de ROS y Ca2+. Aun así, todavía no se sabe si la citrulinación de histonas puede producirse independientemente de que la NE esté activa.
En cuanto a la supresión de la NETosis, la Dectina-1, un receptor fagocítico, inhibe la NETosis al entrar en contacto con microorganismos pequeños, promoviendo la formación de un fagosoma que recluta la NE dentro del núcleo. Por otro lado, receptores como Siglec-5 y Siglec-9 también suprimen la NETosis inhibiendo la generación de ROS y, con ello, la activación de PKC.[7]
Via degradación NETs
Durante una infección las NET se mantienen en la ubicación donde han sido liberadas durante varios días para posteriormente ser eliminadas mediante la DNAasa I (nucleasa plasmática) que degrada el DNA para una posterior fagocitosis por parte de los macrófagos. No se conoce con claridad el proceso de eliminación de las proteínas presentes en las NETs dado a su persistencia pasado la desaparición del DNA. Se intuye su degradación por mecanismos adicionales aún desconocidos.[7]
Tipos de NETosi
Existen tres tipos de NETosi las cuales se diferencian por: Estimulo iniciador, tiempo de respuesta, capacidad funcional de los neutrófilos y mecanismo de generación de las NETs.
NETosi vital
La NETosi vital es aquella que no implica la muerte del neutrófilo y permite la conservación de su función en quimiotaxi y fagocitosis. Este tipo de NETosi se observa ante estimulación mediante patrones moleculares microbianos específicos reconocidos por la célula como el LPS de bacterias gramnegativas. Es una vía de respuesta rápida (menos de 30 minutos) permitiendo el control y la contención de infecciones locales.[9] La respuesta está mediada por vías como TLR4 (Gramnegativos) o TLR2 y CR3 (grampositivos) destacando su activación independiente de ROS.[8] Otro factor diferencial es el mecanismo de liberación del DNA el cual se hace mediante la formación de vesículas con DNA descondesado y proteínas nucleares que son excretadas sin perforación de la membrana plasmática.[5]
NETosi suicida
La NETosi suicida es aquella donde el neutrófilo muere por lisis comportando perdía de funcionalidad. Esta es inducida habitualmente por estimulación química vía PMA generando una respuesta más lenta (horas) pero más persistente. El mecanismo de liberación está mediado por la via Raf-MEK-ERK, la cual activa NADPH oxidasa generando ROS. Esta induce la translocación de la elastasa y PAD4 al núcleo donde se descondensará la cromatina mediante la rotura de histonas y se citrulizarà H3 para causar la descondensacion del DNA. Paralelamente, MPO promueve la rotura de la envoltura nuclear.[15] Estos acontecimientos generan una carga intracelular que causara la rotura de la membrana plasmática y la muerte celular.[8]
NETosi mitocondrial
La NETosi mitocondrial es aquella que forma NETs a partir del DNA mitocondrial de los neutrófilos. Estas NETs se liberan rápidamente (15-20 minutos) después de la exposición de los neutrófilos a LPS, GM-CSF, C5a o bacterias como S. aureus. Este proceso no provoca la muerte celular, pero no se puede considerar NETosi vital porque la liberación del DNA viene promovida por ROS. Los canales de potasio activados por calcio junto a proteínas como SIRT1 promueven la obertura de poros mitocondriales mientras OPA 1 facilita la organización de microtúbulos para la expulsión de este DNA. Este tipo de NETs se ha detectado en pacientes con lesiones óseas postcirugía[10]
NETs y enfermedades
NETs y cancer
Aunque inicialmente se consideraba que las trampas extracelulares de neutrófilos (NETs) eran un mecanismo de defensa contra patógenos, actualmente se sabe que también pueden desempeñar un papel importante en el desarrollo y la progresión del cáncer.
Las NETs pueden crear un microambiente tumoral que favorece el crecimiento y diseminación de las células cancerosas. Pueden actuar como una “red de captura”, atrapando células tumorales circulantes, facilitando su adhesión al endotelio y la colonización de órganos distantes, participando así en la metástasis. Además, enzimas presentes en las NETs, como la catepsina G y la metaloproteinasa MMP-9, pueden estimular la proliferación de células tumorales mediante la liberación de factores como IGF-1 y VEGF. También se ha observado que pueden favorecer la transición epitelial-mesenquimal (EMT) y contribuir a la disfunción de las células T dentro del tumor, dificultando la respuesta inmune.[16]
Se ha observado que niveles elevados de NETs en pacientes con cáncer se asocian con un peor pronóstico y con complicaciones como la trombosis y la falla orgánica. Por este motivo, diferentes estudios consideran la NETosis como una posible diana terapéutica. Algunas de las propuestas incluyen el uso de DNAsas para degradar las NETs, inhibidores de moléculas implicadas en su formación como la NADPH oxidasa o la enzima PAD4, y su combinación con tratamientos inmunoterapéuticos, como los inhibidores de PD-1 o CTLA-4, con el objetivo de mejorar su eficacia y reducir la resistencia tumoral.[16]
NETs y diabetes
En personas con diabetes, especialmente con hiperglucemia persistente, se ha observado una activación excesiva de los neutrófilos, que liberan NETs de forma descontrolada. Esta sobreproducción de NETs se asocia a diferentes complicaciones diabéticas como la retinopatía diabética, la nefropatía diabética, y también está implicada en la cicatrización de heridas, retardando el proceso, o en la aterosclerosis, ya que las NETs pueden promover la inflamación vascular y la formación de placas, aumentando el riesgo cardiovascular en personas con diabetes. La hiperglucemia puede inducir la producción de radicales libres de oxígeno (ROS) a través de la activación de la NADH oxidasa, promoviendo así la formación de NETs.[17]
Por tanto, existen distintos mecanismos por los que la NETosis se relaciona con complicaciones diabéticas.
Diversas moléculas relacionadas con la NETosis pueden dificultar la reparación de heridas en pacientes diabéticos. PAD4, una enzima que favorece la descondensación de la cromatina y la formación de NETs, se encuentra sobreexpresada en neutrófilos de pacientes diabéticos, y se ha visto que retrasa la cicatrización. También se ha observado que el uso de inhibidores de PAD4 o de DNAsas puede mejorar la cicatrización. Otro componente clave es la elastasa, que destruye partes de la matriz extracelular y cuya presencia es más elevada en heridas que no cicatrizan.[17]
La activación de la proteína quinasa C, y en particular de su isoforma PKC-β, está estrechamente relacionada con diversas complicaciones vasculares en pacientes diabéticos. Esta isoforma, junto con la enzima PAD4, se considera uno de los principales desencadenantes de la NETosis. Varios estudios han detectado niveles elevados de PKC-β en muestras de sangre de personas con úlceras de pie diabético, asociándose a una mayor actividad NETótica. El ruboxistaurin, un inhibidor selectivo de PKC-β, ha demostrado resultados positivos, ya que reduce la formación de NETs y contribuye a una mejor cicatrización de las heridas.[17]
En la retinopatía diabética se han detectado niveles elevados de NETs y una mayor presencia de neutrófilos en la retina, lo cual puede favorecer la inflamación y el daño vascular retiniano. Sin embargo, algunos estudios sugieren que las NETs también podrían contribuir a la regeneración eliminando vasos patológicos. Se ha observado que el tratamiento con anti-VEGF reduce la presencia de NETs en la zona afectada.[17]
La NETosis también se ha relacionado con la aterosclerosis. Las NETs pueden activar las células endoteliales y favorecer la formación de placas. En ratones modificados genéticamente, la ausencia de enzimas como NE y PR3 reduce notablemente la formación de dichas placas. Además, factores como el colesterol oxidado o las LDL oxidadas pueden estimular la NETosis mediante la producción de radicales libres y la interacción con receptores inmunitarios específicos.[17]
NET y enfermedades autoimmunes sistémicas
Las enfermedades autoinmunes sistémicas, como la artritis reumatoide, el lupus eritematoso sistémico o la vasculitis asociada a ANCA, se caracterizan por una desregulación del sistema inmunitario que conduce a la producción de anticuerpos e inflamación crónica. En los últimos años se ha observado que el sistema inmunitario innato juega un papel importante en estas enfermedades, especialmente la formación de NETs como un estado de activación de los neutrófilos asociado a la autoinmunidad.[18]
La formación excesiva de NETs y la activación desregulada de las células del sistema inmunitario pueden tener efectos perjudiciales y estar implicadas en el desarrollo de diversas enfermedades inflamatorias de origen inmunitario.
En la artritis reumatoide, una enfermedad crónica que se caracteriza por inflamación sinovial y daño articular, se ha demostrado que los neutrófilos activados tienen un papel importante, y las NETs que generan —formadas por ADN, histonas y enzimas como la mieloperoxidasa y la elastasa— pueden actuar como autoantígenos, favoreciendo la respuesta autoinmune.[18]
Se ha observado que los pacientes con AR presentan una mayor formación espontánea de NETs, especialmente en presencia de autoanticuerpos como los ACPA. Estas estructuras contribuyen a la perpetuación de la inflamación, a la citrulinación de proteínas y al deterioro óseo, y actualmente se investigan como posibles biomarcadores para valorar la actividad de la enfermedad y la respuesta a los tratamientos.[18]
La persistencia de las NETs y la falta de su eliminación contribuyen a la inflamación prolongada y a la cronicidad de la enfermedad. Por tanto, una regulación adecuada de las NETs es esencial para mantener la homeostasis del sistema inmunitario.[18]
Referencias
- ↑ Brinkmann, Volker; Reichard, Ulrike; Goosmann, Christian; Fauler, Beatrix; Uhlemann, Yvonne; Weiss, David S.; Weinrauch, Yvette; Zychlinsky, Arturo (5 de marzo de 2004). «Neutrophil Extracellular Traps Kill Bacteria». Science 303 (5663): 1532-1535. doi:10.1126/science.1092385. Consultado el 6 de mayo de 2025.
- ↑ a b Wang, Yijie; Du, Chunjing; Zhang, Yue; Zhu, Liuluan (29 de marzo de 2024). «Composition and Function of Neutrophil Extracellular Traps». Biomolecules (en inglés) 14 (4): 416. ISSN 2218-273X. PMC 11048602. PMID 38672433. doi:10.3390/biom14040416. Consultado el 6 de mayo de 2025.
- ↑ Masucci, Maria Teresa; Minopoli, Michele; Del Vecchio, Silvana; Carriero, Maria Vincenza (16 de septiembre de 2020). «The Emerging Role of Neutrophil Extracellular Traps (NETs) in Tumor Progression and Metastasis». Frontiers in Immunology (en inglés) 11. ISSN 1664-3224. doi:10.3389/fimmu.2020.01749. Consultado el 6 de mayo de 2025.
- ↑ Camicia, Gabriela; de Larrañaga, Gabriela (19 de enero de 2013). «Trampas extracelulares de neutrófilos: un mecanismo de defensa con dos caras». Medicina Clínica 140 (2): 70-75. ISSN 0025-7753. doi:10.1016/j.medcli.2012.04.022. Consultado el 6 de mayo de 2025.
- ↑ a b Thiam, Hawa Racine; Wong, Siu Ling; Wagner, Denisa D.; Waterman, Clare M. (6 de octubre de 2020). «Cellular Mechanisms of NETosis». Annual Review of Cell and Developmental Biology (en inglés) 36 (Volume 36, 2020): 191-218. ISSN 1081-0706. PMC 8499668. PMID 32663035. doi:10.1146/annurev-cellbio-020520-111016. Consultado el 6 de mayo de 2025.
- ↑ Steinberg, Benjamin E.; Grinstein, Sergio (27 de marzo de 2007). «Unconventional Roles of the NADPH Oxidase: Signaling, Ion Homeostasis, and Cell Death». Science's STKE 2007 (379): pe11-pe11. doi:10.1126/stke.3792007pe11. Consultado el 6 de mayo de 2025.
- ↑ a b c d e f g Papayannopoulos, Venizelos (2018-02). «Neutrophil extracellular traps in immunity and disease». Nature Reviews Immunology (en inglés) 18 (2): 134-147. ISSN 1474-1741. doi:10.1038/nri.2017.105. Consultado el 6 de mayo de 2025.
- ↑ a b c Yipp, Bryan G.; Kubes, Paul (17 de octubre de 2013). «NETosis: how vital is it?». Blood 122 (16): 2784-2794. ISSN 0006-4971. doi:10.1182/blood-2013-04-457671. Consultado el 6 de mayo de 2025.
- ↑ a b Masuda, Sakiko; Nakazawa, Daigo; Shida, Haruki; Miyoshi, Arina; Kusunoki, Yoshihiro; Tomaru, Utano; Ishizu, Akihiro (1 de agosto de 2016). «NETosis markers: Quest for specific, objective, and quantitative markers». Clinica Chimica Acta 459: 89-93. ISSN 0009-8981. doi:10.1016/j.cca.2016.05.029. Consultado el 6 de mayo de 2025.
- ↑ a b Wang, Yijie; Du, Chunjing; Zhang, Yue; Zhu, Liuluan (29 de marzo de 2024). «Composition and Function of Neutrophil Extracellular Traps». Biomolecules (en inglés) 14 (4): 416. ISSN 2218-273X. PMC 11048602. PMID 38672433. doi:10.3390/biom14040416. Consultado el 6 de mayo de 2025.
- ↑ Brinkmann, Volker; Zychlinsky, Arturo (3 de septiembre de 2012). «Neutrophil extracellular traps: Is immunity the second function of chromatin?». Journal of Cell Biology 198 (5): 773-783. ISSN 0021-9525. doi:10.1083/jcb.201203170. Consultado el 6 de mayo de 2025.
- ↑ Vorobjeva, N. V.; Chernyak, B. V. (1 de octubre de 2020). «NETosis: Molecular Mechanisms, Role in Physiology and Pathology». Biochemistry (Moscow) (en inglés) 85 (10): 1178-1190. ISSN 1608-3040. PMC 7590568. PMID 33202203. doi:10.1134/S0006297920100065. Consultado el 6 de mayo de 2025.
- ↑ «Trampas extracelulares de neutrófilos (NET) consequencia de un suicido celular».
- ↑ Jorch, Selina K.; Kubes, Paul (2017-03). «An emerging role for neutrophil extracellular traps in noninfectious disease». Nature Medicine (en inglés) 23 (3): 279-287. ISSN 1546-170X. doi:10.1038/nm.4294. Consultado el 6 de mayo de 2025.
- ↑ Masuda, Sakiko; Nakazawa, Daigo; Shida, Haruki; Miyoshi, Arina; Kusunoki, Yoshihiro; Tomaru, Utano; Ishizu, Akihiro (1 de agosto de 2016). «NETosis markers: Quest for specific, objective, and quantitative markers». Clinica Chimica Acta 459: 89-93. ISSN 0009-8981. doi:10.1016/j.cca.2016.05.029. Consultado el 6 de mayo de 2025.
- ↑ a b Jaboury, Sarah; Wang, Kenny; O’Sullivan, Kim Maree; Ooi, Joshua Daniel; Ho, Gwo Yaw (18 de abril de 2023). «NETosis as an oncologic therapeutic target: a mini review». Frontiers in Immunology (en inglés) 14. ISSN 1664-3224. PMC 10151565. PMID 37143649. doi:10.3389/fimmu.2023.1170603. Consultado el 6 de mayo de 2025.
- ↑ a b c d e Zhu, Yuyan; Xia, Xuan; He, Qian; Xiao, Qing-Ao; Wang, Decheng; Huang, Meirong; Zhang, Xiaolin (3 de agosto de 2023). «Diabetes-associated neutrophil NETosis: pathogenesis and interventional target of diabetic complications». Frontiers in Endocrinology (en inglés) 14. ISSN 1664-2392. PMC 10435749. PMID 37600700. doi:10.3389/fendo.2023.1202463. Consultado el 6 de mayo de 2025.
- ↑ a b c d Frade-Sosa, Beatriz; Sanmartí, Raimon (1 de noviembre de 2023). «Neutrophils, neutrophil extracellular traps, and rheumatoid arthritis: An updated review for clinicians». Reumatología Clínica (English Edition) 19 (9): 515-526. ISSN 2173-5743. doi:10.1016/j.reumae.2023.10.002. Consultado el 6 de mayo de 2025.