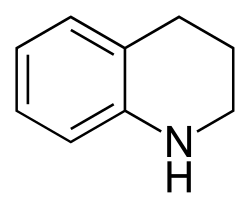
Tetrahidroquinolina
| Tetrahidroquinolina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1,2,3,4-tetrahidroquinolina | ||
| General | ||
| Fórmula molecular | C9H11N | |
| Identificadores | ||
| Número CAS | 635-46-1[1] | |
| ChEBI | CHEBI:213323 | |
| ChEMBL | CHEMBL303611 | |
| ChemSpider | 62667 | |
| PubChem | 69460 | |
| UNII | CCR50N1Z9G | |
| Propiedades físicas | ||
| Apariencia | Líquido oleoso incoloro | |
| Densidad | 1056 kg/m³; 1,056 g/cm³ | |
| Masa molar | 133,194 g/mol | |
| Punto de fusión | 20 °C (293 K) | |
| Peligrosidad | ||
| SGA |
 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La tetrahidroquinolina es un compuesto orgánico que es el derivado semihidrogenado de la quinolina. Es un aceite incoloro.
Usos
Los derivados sustituidos de la tetrahidroquinolina son comunes en la química medicinal.[2] La oxamniquina, la dinemicina, la viratmicina y el nicainoprol son tetrahidroquinolinas bioactivas.[3] Normalmente, los derivados de tetrahidroquinolina se preparan mediante hidrogenación parcial de la quinolina correspondiente utilizando catalizadores heterogéneos.
Síntesis
Las tetrahidroquinolinas se producen por hidrogenación de quinolinas. Debido a que la hidrogenación es reversible, la tetrahidroquinolina se ha examinado a menudo como un disolvente donante de hidrógeno en la licuefacción del carbón.
Utilizando catalizadores homogéneos, se ha demostrado la hidrogenación asimétrica.[4] También se puede preparar a partir de 1-indanona (benzociclopentanona).[5]
Referencias
- ↑ Número CAS
- ↑ Sridharan, Vellaisamy; Suryavanshi, Padmakar A.; Menéndez, J. Carlos (2011). «Advances in the Chemistry of Tetrahydroquinolines». Chemical Reviews 111 (11): 7157-7259. PMID 21830756. doi:10.1021/cr100307m.
- ↑ Katritzky, Alan R.; Rachwal, Stanislaw; Rachwal, Bogumila (1996). «Recent Progress in the Synthesis of 1,2,3,4-Tetrahydroquinolines». Tetrahedron 52 (48): 15031-15070. doi:10.1016/S0040-4020(96)00911-8.
- ↑ Chen, Fei; Ding, Zi-Yuan; He, Yan-Mei; Fan, Qing-Hua (2015). «Synthesis of Optically Active 1,2,3,4-Tetrahydroquinolines via Asymmetric Hydrogenation Using Iridium-Diamine Catalyst». Organic Syntheses 92: 213-226. doi:10.15227/orgsyn.092.0213.
- ↑ Imaizumi, Taku; Okano, Kentaro; Tokuyama, Hidetoshi (2016). «DIBALH-Mediated Reductive Ring-Expansion Reaction of Cyclic Ketoxime». Organic Syntheses 93. pp. 1-13. ISBN 9780471264224. doi:10.1002/0471264229.os093.01.