Tetrafluoroborato de plata
| Tetrafluoroborato de plata | ||
|---|---|---|
| General | ||
| Fórmula estructural |
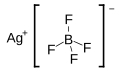 | |
| Fórmula molecular | AgBF4 | |
| Identificadores | ||
| Número CAS | 14104-20-2[1] | |
| Número RTECS | ED2875000 | |
| ChemSpider | 140438 | |
| PubChem | 159722 | |
| Propiedades físicas | ||
| Masa molar | 193,908015 g/mol | |
El tetrafluoroborato de plata es un compuesto inorgánico cuya fórmula química es AgBF4. Es un sólido blanco, aunque las muestras comerciales suelen ser grises, que se disuelve en disolventes orgánicos polares y en agua.[2]
Preparación
El tetrafluoroborato de plata puede prepararse por varios métodos. Una vía sencilla consiste en disolver carbonato de plata en ácido tetrafluorobórico acuoso. [3] También se puede producir tratando el fluoruro de plata (I) con trifluoruro de boro en solución de nitrometano . La reacción entre el trifluoruro de boro y una suspensión de óxido de plata en benceno es otra vía que aprovecha la solubilidad del compuesto en benceno. Sin embargo, este método produce fulminato de plata, un explosivo sensible. [4]
Usos en laboratorio
En el laboratorio de química inorgánica y organometálica, el tetrafluoroborato de plata, también denominado «BF₄ de plata», se utiliza como reactivo para eliminar ligandos halogenados y para oxidar complejos ricos en electrones. En diclorometano, el tetrafluoroborato de plata es un oxidante moderadamente fuerte.[5] Al igual que el hexafluorofosfato de plata, se suele utilizar para sustituir aniones haluro o ligandos por aniones tetrafluoroborato de coordinación débil. La abstracción del haluro se impulsa mediante la precipitación del haluro de plata correspondiente.
Estructura
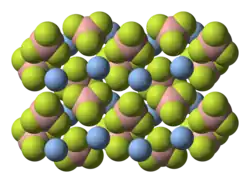
Según la cristalografía de rayos X, el compuesto sólido está formado por centros de Ag+ unidos a cuatro sitios de fluoruro del BF4-.[6]
Referencias
- ↑ Número CAS
- ↑ Wistrand, Lars-G.; Kerekes, Angela D.; Sannigrahi, Mousumi (2005). «Silver Tetrafluoroborate». Encyclopedia of Reagents for Organic Synthesis. ISBN 0-471-93623-5. doi:10.1002/047084289X.rs028.pub2.
- ↑ Chalker, Justin M.; Thompson, Amber L.; Davis, Benjamin (2010). «Safe and Scalable Preparation of Barluenga's Reagent». Organic Syntheses 87: 288. doi:10.15227/orgsyn.087.0288.
- ↑ The preparation of silver fluoroborate: a warning. doi:10.1016/s0040-4039(01)99266-4.
- ↑ N. G. Connelly, W. E. Geiger (1996). «Chemical Redox Agents for Organometallic Chemistry». Chemical Reviews 96 (2): 877-910. PMID 11848774. doi:10.1021/cr940053x.
- ↑ Evgeny Goreshnik, Zoran Mazej, "X-ray single crystal structure and vibrational spectra of AgBF4" Solid State Sciences 2005, Volume 7, pp. 1225–1229. doi 10.1016/j.solidstatesciences.2005.06.007
Enlaces externos
- Esta obra contiene una traducción derivada de «Silver tetrafluoroborate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.