Terc-butóxido de potasio
| Terc-butóxido de potasio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Terc-butóxido de potasio | ||
| General | ||
| Fórmula estructural | (CH3)3COK | |
| Fórmula molecular | C4H9KO | |
| Identificadores | ||
| Número CAS | 865-47-4[1] | |
| ChemSpider | 63266 | |
| PubChem | 23665647 | |
| UNII | VR838VHE0V | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco o amarillento | |
| Masa molar | 112,213 g/mol | |
| Punto de fusión | 220 °C (493 K) | |
| Peligrosidad | ||
| SGA |
   | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El terc-butóxido de potasio (o t-butóxido de potasio) es un compuesto químico con la fórmula [(CH3)3COK]n (abr. tBuOK). Este sólido incoloro es una base fuerte (el pKa del ácido conjugado es 17 en H2O),[2] que es útil en la síntesis orgánica. El compuesto se representa a menudo como una sal y a menudo se comporta como tal, pero su ionización depende del disolvente.[3]
Preparación
El terc-butóxido de potasio está disponible comercialmente como solución y como sólido, pero a menudo se genera in situ para uso en laboratorio porque las muestras son muy sensibles a la humedad y las muestras más antiguas suelen ser de baja pureza. Se prepara mediante la reacción del alcohol terc-butílico seco con potasio metálico.[4]
El sólido se obtiene evaporando estas soluciones seguido de calentamiento del sólido. El sólido se puede purificar por sublimación.
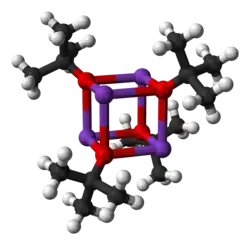
Estructura
Cristaliza como un clúster tetramérico de tipo cubano. Cristaliza con una mezcla tetrahidrofurano/pentano a -20 °C como [tBuOK·tBuOH]∞, que consiste en cadenas lineales unidas por enlaces de hidrógeno. La sublimación de [tBuOK·tBuOH] ∞ produce el tetrámero [tBuOK]4, que adopta una estructura similar a la del cubano. Los disolventes ligeramente básicos de Lewis, como el THF y el éter dietílico, no rompen la estructura tetramérica, que persiste en el sólido, en solución e incluso en la fase gaseosa.[5]
Reacciones
Como base
Se han reportado muchas modificaciones que influyen en la reactividad de este reactivo. El compuesto adopta una estructura de grupo compleja (la imagen adyacente es una caricatura simplificada) y los aditivos que modifican el grupo afectan la reactividad del reactivo. Por ejemplo, DMF, DMSO, hexametilfosforamida (HMPA) y 18-corona-6 interactúan con el centro de potasio, produciendo pares de iones separados por solvente como K(DMSO)x+ y terc-BuO−. Por el contrario, en el benceno el compuesto permanece con una estructura de clúster, que es menos básica.[3] Incluso en disolventes polares, no es tan fuerte como las bases de amida, por ejemplo, la diisopropilamida de litio, pero es más fuerte que el hidróxido de potasio. Su volumen estérico inhibe que el grupo participe en la adición nucleofílica, como en una síntesis de Williamson o reacciones SN2 relacionadas.
Los sustratos que son desprotonados por el t-butóxido de potasio incluyen acetilenos terminales y compuestos de metileno activos. Es útil en reacciones de deshidrohalogenación. Para ilustrar este último comportamiento, el terc-butóxido de potasio reacciona con cloroformo produciendo diclorocarbeno, que es útil para las ciclopropanaciones de dicloro.[6][7] El terc-butóxido de potasio puede abstraer un protón beta de los cationes alquilamonio, lo que conduce al producto de Hofmann a través de una reacción de eliminación.
Otras reacciones
El terc-butóxido de potasio cataliza la reacción de hidrosilanos y compuestos heterocíclicos para dar los derivados de sililo, con liberación de H2.[8]
Seguridad
El terc-butóxido de potasio es una base muy fuerte que ataca rápidamente al tejido vivo.
El terc-butóxido de potasio forma mezclas explosivas cuando se trata con diclorometano.[9][10]
Compuestos relacionados
- terc-butóxido de sodio
- terc-butóxido de litio
Referencias
- ↑ Número CAS
- ↑ «Bordwell pKa Table». organicchemistrydata.org. Consultado el 21 de marzo de 2025.
- ↑ a b Caine, D. (2006). «Potassium tert-Butoxide». e-EROS Encyclopedia of Reagents for Organic Synthesis. ISBN 0471936235. doi:10.1002/047084289X.rp198.pub2.
- ↑ «β-Carbethoxy-γ,γ-diphenylvinylacetic acid». Organic Syntheses; Collected Volumes 4: 132. 1963.
- ↑ Chisholm, Malcolm H.; Drake, Simon R.; Naiini, Ahmad A.; Streib, William E. (1991). «Synthesis and X-ray crystal structures of the one-dimensional ribbon chains [MOBut·ButOH]∞ and the cubane species [MOBut]4 (M = K and Rb)». Polyhedron 10 (3): 337-345. doi:10.1016/S0277-5387(00)80154-0.
- ↑ Brown, William; Foote, Christopher; Iverson, Brent; Anslyn, Eric (10 de enero de 2008). Organic Chemistry (en inglés). Cengage Learning. ISBN 978-0495388579.
- ↑ Margaret-Ann Armour (19 de abril de 2016). Hazardous Laboratory Chemicals Disposal Guide, Third Edition (en inglés). CRC Press. ISBN 9781420032383.
- ↑ Anton A. Toutov, Wen-Bo Liu, Kerry N. Betz, Alexey Fedorov, Brian Stoltz, Robert H. Grubbs (2015). «Silylation of C–H bonds in aromatic heterocycles by an Earth-abundant metal catalyst». Nature 518 (7537): 80-84. Bibcode:2015Natur.518...80T. PMID 25652999. doi:10.1038/nature14126.
- ↑ Foden, Charles R.; Weddell, Jack L. (29 de diciembre de 1991). Hazardous Materials: Emergency Action Data (en inglés). CRC Press. ISBN 9780873715980.
- ↑ Bretherick, L. (1990). Handbook of Reactive Chemical Hazards 4 ed. (en inglés). Dichloromethane - Reactivities / Incompatibilities in NIH National Library of Medicine. p. 475. ISBN 9781483284668.