Sulfato de berilio
| Sulfato de berilio | ||
|---|---|---|
 | ||
| General | ||
| Fórmula estructural |
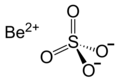 | |
| Fórmula molecular | [Be(H2O4]SO4 | |
| Identificadores | ||
| Número CAS | 13510-49-1[1] | |
| Número RTECS | DS4800000 | |
| ChEBI | 53473 | |
| ChEMBL | CHEMBL3305984 | |
| ChemSpider | 24291 | |
| PubChem | 73555519 26077, 73555519 | |
| UNII | 01UQ1KPC7E | |
| Propiedades físicas | ||
| Densidad | 2440 kg/m³; 2,44 g/cm³ | |
| Masa molar | 104,964 g/mol | |
| Punto de fusión | 110 °C (383 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El sulfato de berilio, que normalmente se encuentra en forma de tetrahidrato, [Be(H2O4]SO4 y es un sólido cristalino de color blanco. Fue aislado por primera vez en 1815 por Jöns Jakob Berzelius.[2] El sulfato de berilio se puede preparar tratando una solución acuosa de muchas sales de berilio con ácido sulfúrico, seguido de evaporación de la solución y cristalización. El producto hidratado puede convertirse en sal anhidra calentándolo a 400 °C.[3]
Estructura
Según la cristalografía de rayos X, el tetrahidrato contiene una unidad tetraédrica Be(OH2)42+ y aniones sulfato. El pequeño tamaño del catión Be2+ determina el número de moléculas de agua que pueden coordinarse.[4] En contraste, la sal de magnesio análoga MgSO4·6H2O contiene una unidad octaédrica Mg(OH2)62+. [5]La existencia del ion tetraédrico [Be(OH2)4]2+ en soluciones acuosas de nitrato de berilio y cloruro de berilio ha sido confirmada mediante espectroscopia vibracional. [6]
El compuesto anhidro tiene una estructura similar a la del fosfato de boro. Contiene alternancia de berilio y azufre coordinados tetraédricamente, y cada oxígeno tiene dos coordenadas (Be-O-S). La distancia entre el Be y el O es de 156 pm, y la distancia entre el S y el O es de 150 pm. [7]
Una mezcla de berilio y sulfato de radio se utilizó como fuente de neutrones en el descubrimiento de la fisión nuclear.
Referencias
- ↑ Número CAS
- ↑ Lathrop Parsons, Charles (1909), The Chemistry and Literature of Beryllium, London, pp. 29-33, ISBN 9780559264160..
- ↑ Patnaik, Pradyot (2002), Handbook of Inorganic Chemicals, McGraw-Hill, ISBN 0-07-049439-8..
- ↑ Kellersohn, T.; Delaplane, R. G.; Olovsson, I. (1994). «The synergetic effect in beryllium sulfate tetrahydrate – an experimental electron-density study». Acta Crystallographica Section B: Structural Science 50 (3): 316-326. doi:10.1107/S010876819400039X.
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Rudolph, Wolfram W.; Fischer, Dieter; Irmer, Gert; Pye, Cory C. (2009). «Hydration of Beryllium(II) in Aqueous Solutions of Common Inorganic Salts. A Combined Vibrational Spectroscopic and ab initio Molecular Orbital Study». Dalton Transactions (33): 6513-6527. PMID 19672497. doi:10.1039/B902481F.
- ↑ Grund, Alfred (1955). «Die Kristallstruktur von BeSO4». Tschermaks Mineralogische und Petrographische Mitteilungen 5 (3): 227-230. Bibcode:1955MinPe...5..227G. ISSN 0041-3763. doi:10.1007/BF01191066.
Enlaces externos
- International Chemical Safety Card 1351
- IARC Monograph "Beryllium and Beryllium Compounds"
- IPCS Health & Safety Guide 44
- IPCS Environmental Health Criteria 106: Beryllium
- IPCS CICAD 32
- Esta obra contiene una traducción derivada de «Beryllium sulfate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.