Sales de Tutton
Las sales de Tutton son una familia de sales con la fórmula M2M'(SO4)2(H2O)6 (sulfatos) o M2M'(SeO4)2(H2O)6 (selenatos). Estos materiales son sales dobles, lo que significa que contienen dos cationes diferentes, M+ y M'2+ cristalizados en la misma red iónica regular. El catión univalente puede ser potasio, rubidio, cesio, amonio (NH4), amonio deuterado (ND4) o talio. Los iones de sodio o litio son demasiado pequeños. El catión divalente puede ser magnesio, vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre, zinc o cadmio. Además del sulfato y el selenato, el anión divalente puede ser cromato (CrO42−), tetrafluoroberilato (BeF42−), hidrogenofosfato (HPO42−) [1] o monofluorofosfato (PO3F2−). Las sales de Tutton cristalizan en el grupo espacial monoclínico P21/a.[2] La robustez es el resultado de los enlaces de hidrógeno complementarios entre los aniones y cationes tetraédricos, así como de sus interacciones con el complejo metálico-acuoso [M(H2O)6]2+.
Ejemplos y compuestos relacionados
Quizás la más conocida sea la sal de Mohr, sulfato de amonio ferroso (NH4)2Fe(SO4)2.(H2O)6).[3] Otros ejemplos incluyen la sal vanadosa de Tutton (NH4)2V(SO4)2(H2O)6 y la sal cromosa de Tutton (NH4)2Cr(SO4)2(H2O)6. En sólidos y disoluciones, el ion M'2+ existe como un complejo metálico-acuoso [M'(H2O)6]2+.
Emparentados con las sales de Tutton están los alumbres, que también son sales dobles pero con la fórmula MM'(SO4)2(H2O)12. Las sales de Tutton antiguamente se denominaban "falsos alumbres". [4]
-
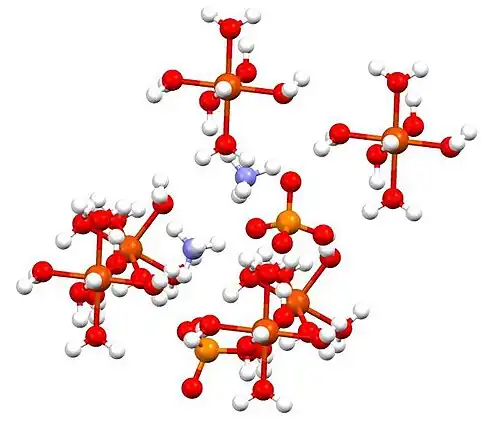 Celda unitaria de sulfato de amonio ferroso (N es violeta, O es rojo, S es naranja, Fe es rojo grande).
Celda unitaria de sulfato de amonio ferroso (N es violeta, O es rojo, S es naranja, Fe es rojo grande). -
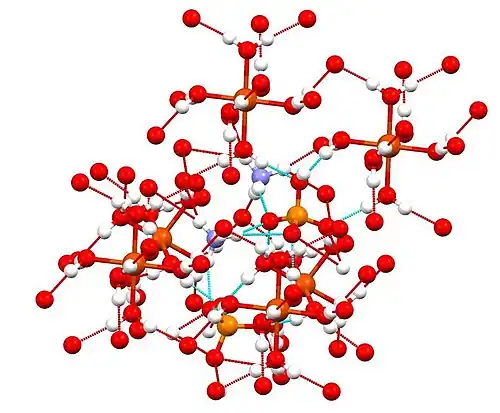 La misma estructura con red de enlaces de hidrógeno resaltada.
La misma estructura con red de enlaces de hidrógeno resaltada.
Historia
Las sales de Tutton a veces se denominan Schönites, en honor al mineral natural llamado Schönita (K2Mg(SO4)2(H2O)6). Su nombre se debe a Alfred Edwin Howard Tutton, quien identificó y caracterizó una amplia gama de estas sales alrededor de 1900.[5]Estas sales fueron de importancia histórica porque se podían obtener con alta pureza y servían como reactivos confiables y estándares espectroscópicos.
Tabla de sales
| M1 | M2 | Fórmula | Nombre | a Å | b Å | c Å | β° | V Å3 | Color | Nα | Nβ | Nγ | Biaxial | 2V | otro |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| K | Cd | K2[Cd(H2O)6](SO4)2 | Sulfato de potasio y cadmio hexahidratado[6] | ||||||||||||
| Cs | Cd | Cs2[Cd(H2O)6](SO4)2 | Sulfato de cadmio y cesio hexahidratado[7] | ||||||||||||
| NH4 | Cd | (NH4)2[Cd(H2O)6](SO4)2 | Sulfato de cadmio y amonio hidratado | 9.395 | 12.776 | 6.299 | 106°43′ | 727.63 | incoloro | l.486 | 1.488 | 1.494 | Biaxial(-f) | grande[8] | densidad=2.05[9]
Pierde agua lentamente en el aire seco.[10] |
| K | Co | K2[Co(H2O)6](SO4)2[11] | Sulfato de hexaaquacobalto(II) de potasio[12] | 6.151 | 9.061 | 12.207 | 104.8° | 657.78[13] | rojo | densidad=2.21 | |||||
| Rb | Co | Rb2[Co(H2O)6](SO4)2 | Sulfato de hexaaquacobalto(II) de rubidio | 6.24 | 9.19 | 12.453 | 105.99° | 686.5[10] | Rojo rubí[14] | desnsidad=2.56 | |||||
| Cs | Co | Cs2[Co(H2O)6](SO4)2 | Sulfato de hexaaquacobalto(II) de cesio | 9.318(1) | 12.826(3) | 6.3650(9) | 107.13(1)° | 727.0[15] | Rojo oscuro | ||||||
| NH4 | Co | (NH4)2[Co(H2O)6](SO4)2[16] | Sulfato de hexaaquacobalto(II) de amonio | 6.242 | 9.255 | 12.549 | 106.98° | 693.3[17] | Morado[18] | densidad=1.89 | |||||
| Tl | Co | Tl2[Co(H2O)6](SO4)2 | Sulfato de hexaaquacobalto(II) de talio | 9.227(1) | 12.437(2) | 6.220(1) | 106.40(1)° | 684.7 | Rojo claro[19] | ||||||
| Tl | Co | Tl2[Co(H2O)6](SO4)2 | sulfato de cobalto y ditalo hexahidrato | 9.235(1) | 12.442(2) | 6.227(1) | 106.40(1)° | Rosa amarillento | 1.599 | 1.613 | 1.624 | biaxial(-) | mediano grande[20] | densidad=4.180 g/cm3 | |
| Rb | Cr | Rb2[Cr(H2O)6](SO4)2[21] | Sulfato de cromo y dirubidio hexahidrato | ||||||||||||
| Cs | Cr | Cs2[Cr(H2O)6](SO4)2[21] | sulfato de cromo dicasio hexahidrato | ||||||||||||
| ND4 | Cr | (ND4)2Cr(SO4)2·6H2O[21] | Sulfato de cromo y diamonio deuterado hexahidratado | Azul brillante, | formado a partir de con sulfato de amonio en una cantidad mínima de agua bajo nitrógeno gaseoso. Estable en el aire frente a la oxidación, pero puede deshidratarse.[22] | ||||||||||
| K | Cu | K2[Cu(H2O)6](SO4)2 | Cianocroita[12] | 9.27 | 12.44 | 6.30 | 104.47[23] | 663.0[23] | Azul verde pálido | densidad=2.21[23] dentro de la celda unitaria 7,76 entre dos átomos de Cu[24] | |||||
| Rb | Cu | Rb2[Cu(H2O)6](SO4)2 | Sulfato de hexaaquacobre de dirubidio | 9.267 | 12.366 | 6.228 | 105°19′ | 686.8 | Azul verdoso brillante | 1.488 | 1.491 | 1.506 | biaxial (+)[25] | mediano | densidad=2.580g/cm³[8] Cu-O 2.098 Å Rb-O 3.055 Å.[25] |
| Cs | Cu | Cs2[Cu(H2O)6](SO4)2[26] | Sulfato de hexaaquacobre dicasio | 9.439 | 12.762 | 6.310 | 106°11′ | 718.5 | Azul verdoso brillante | 1.504 | 1.506 | 1.514 | biaxial (+) | densidad=2.864g/cm³[27] | |
| NH4 | Cu | (NH4)2[Cu(H2O)6](SO4)2 | Sulfato de hexaaquacobre(II) de amonio[28] | 6.31 | 12.38 | 9.22 | 106.16° | 691.25[29] | densidad=1.921;[29] calor de formación=-777,9 kcal/mol[29] El eje de distorsión de Jahn-Teller cambia bajo una presión de ~1500 bares, el eje a, b se contrae un 3,3% y un 3,5% y el eje c se extiende un 4,5%.[28] | ||||||
| Tl | Cu | Tl2[Cu(H2O)6](SO4)2 | Sulfato de cobre y talio hidratado | 9.268 | 12.364 | 6.216 | 105°33′ | Azul verdoso brillante | 1.600 | 1.610 | 1.620 | biaxial | muy grande[30] | densidad=3.740 g/cm³ | |
| K | Fe | K2[Fe(H2O)6](SO4)2 | Sulfato de hierro y dipotasio hexahidratado[12] | ||||||||||||
| Rb | Fe | Rb2[Fe(H2O)6](SO4)2 | Sulfato de hierro y rubidio hidratado | 9.218 | 12.497 | 6.256 | 105°45′ | Verde pálido | 1.480 | 1.489 | 1.501 | biaxial (+) | grande, | densidad=2.523g/cm³[31] | |
| Cs | Fe | Cs2[Fe(H2O)6](SO4)2 | Sulfato de hexaaquahierro(II) de cesio | 9.357(2) | 12.886(2) | 6.381(1) | 106.94(1)° | 736.0 | Amarillo oscuro[15] Verde muy pálido | 1.501 | 1.504 | 1.516 | biaxial (+) | mediano[32] | densidad=2.805 |
| NH4 | Fe | (NH4)2[Fe(H2O)6](SO4)2 | Mohrita[12] | 6.24(1) | 12.65(2) | 9.32(2) | 106.8(1) | 704.28 | Verde pálido vítreo | densidad=1.85 nombrado en honor a Karl Friedrich Mohr[33] | |||||
| Tl | Fe | Tl2[Fe(H2O)6](SO4)2 | Sulfato de hexaaquahierro(II) de talio | 9.262(2) | 12.497(1) | 6.235(2) | 106.15(1)° | 693.2[19] | Verde claro | 1.590 | 1.605 | =1.616 | biaxial (-) | grande | densidad=3.662g/cm³[34] |
| K | Mg | K2[Mg(H2O)6](SO4)2 | picromerita | 9.04 | 12.24 | 6.095 | 104°48′[12] | Incoloro o blanco | 1.460 | 1.462 | 1.472 | biaxial (+) | mediano | densidad=2.025g/cm³;[35] Segunda esfera de coordinación ampliada alrededor de Mg.[12] | |
| Rb | Mg | Rb2[Mg(H2O)6](SO4)2 | Sulfato de rubidio y magnesio hexahidratado[36] | 9.235 | 12.486 | 6.224 | 105°59′ | Incoloro | 1.467 | 1.469 | 1.476[37] | biaxial | |||
| Cs | Mg | Cs2[Mg(H2O)6](SO4)2 | Sulfato de hexaaquamagnesio y cesio | 9.338(2) | 12.849(4) | 6.361(2) | 107.07(2)° | 729.6 | Incoloro[15] | 1.481 | 1.485 | 1.492 | biaxial(+) | mediano | densidad=2.689[38] |
| NH4 | Mg | (NH4)2[Mg(H2O)6](SO4)2 | Boussingaultita | 9.28 | 12.57 | 6.2 | 107°6′[12][16] | ||||||||
| NH4 | Mg | (NH4)2[Mg(H2O)6](SO4)2 | Óxido de cromo, magnesio y amonio hidratado | 9.508±.001 | 12.674 | 6.246 | 106°14′ | Amarillo brillante | 1.637 | 1.638 | 1.653 | biaxial(+) | pequeño | densidad=1.840 g/cm 3[8] | |
| Tl | Mg | Tl2[Mg(H2O)6](SO4)2[39] | Sulfato de magnesio y ditalo hexahidrato | 9.22 9.262(2) | 12.42 12.459(2) | 6.185 6.207(1) | 106°30′ 106.39(2)° | 687.1 | Incoloro[19] | densidad=3.532 g/cm3 | |||||
| Rb | Mn | Rb2[Mn(H2O)6](SO4)2 | Sulfato de hexaaquamanganeso (VI) de dirubidio | 9.282(2) | 12.600(2) | 6.254(2) | 105.94(2) | 703.3Å3[40][41] | |||||||
| Cs | Mn | Cs2[Mn(H2O)6](SO4)2 | Sulfato de hexaaquamanganeso(II) de cesio | 9.418(3) | 12.963(2) | 6.386(3) | 107.17(4)° | 744.9 | Rosa pálido[15] | 1.495 | 1.497 | 1.502 | biaxial(+) | grande | densidad=2.763[42] |
| NH4 | Mn | (NH4)2[Mn(H2O)6](SO4)2 | Sulfato de manganeso y amonio hexahidratado | 9.40 | 12.74 | 6.26 | 107.0°[43] | Rosa pálido | 1.482 | 1.456 | 1.492 | biaxial(+) | grande | densidad=1.827 [44] | |
| Tl | Mn | Tl2[Mn(H2O)6](SO4)2 | Sulfato de manganeso y talio hexahidratado | 9.3276(6), 9.322(2) | 12.5735(8), 12.565(2) | 6.2407(4), and 6.233(1) | 106.310(3)°[45] 106.29(2)°, | 700.8[19] | Rosa brillante | ||||||
| K | Ni | K2Ni(SO4)2·6H2O[11] | Sulfato de níquel y potasio hexahidratado[12]utilizado como filtro UV[46] | ||||||||||||
| Rb | Ni | Rb2[Ni(H2O)6](SO4)2 | Sulfato de níquel y rubidio hexahidratado | 6.221 | 12.41 | 9.131 | 106.055° | 677.43 | |||||||
| Cs | Ni | Cs2[Ni(H2O)6](SO4)2 | Sulfato de hexaquaniquel(II) y cesio | 9.259(2) | 12.767(2) | 6.358(1) | 107.00(2)° | 718.7[15] | Azul verdoso | 1.507 | 1.512 | 1.516 | biaxial(-) | muy grande | densidad=2.883 [47] utilizado como filtro UV[46] |
| NH4 | Ni | (NH4)2[Ni(H2O)6](SO4)2 | Níquel-boussingaultita[12][48] | 9.186 | 12.468 | 6.424 | 684.0 | Verde azulado.[49][50] | densidad=1.918 N.º CAS=51287-85-5 | ||||||
| Tl | Ni | Tl2[Ni(H2O)6](SO4)2 | Sulfato de hexaaquaniquel(II) de talio | 9.161(2) | 12.389(2) | 6.210(2) | 106.35(2)° | 676.3 | Azul verdoso[19] | 1.602 | 1.615 | 1.620 | biaxial(-) | grande | densidad=3.763[51] |
| K | Ru | K2[Ru(H2O)6](SO4)2 | [52] | 8.950 | 12.268 | 6.135 | 105.27 | 644 | |||||||
| Rb | Ru | Rb2[Ru(H2O)6](SO4)2 | [52] | 9.132 | 12.527 | 6.351 | 106.30 | ||||||||
| K | V | K2[V(H2O)6](SO4)2 | Vanadium(II) potassium sulfate hexahydrate [53] | ||||||||||||
| Rb | V | Rb2[V(H2O)6](SO4)2 | Sulfato de rubidio y vanadio (II) | ||||||||||||
| NH4 | V | (NH4)2[V(H2O)6](SO4)2 | Sulfato de vanadio(II) y amonio hexahidratado | 9.42 | 12.76 | 6.22 | 107.2° | 714.2 | Amatista | densidad=1.8[54] | |||||
| K | Zn | K2[Zn(H2O)6](SO4)2[11][12] | Sulfato de zinc y dipotasio hexahidrato | 9.041 | 12.310 | 6.182 | 104.777° | Incoloro | 1.478 | 1.481 | 1.496 | biaxial | grande | densidad=2.242g/cm³[55] Descomposición térmica a 252K.[56] | |
| Rb | Zn | Rb2[Zn(H2O)6](SO4)2 | Sulfato de rubidio y zinc hexahidratado[57] | 9.185 | 12.450 | 6.242 | 105°54′ | Incoloro | 1.483 | 1.489 | 1.497 | biaxial | grande[58] | ||
| Cs | Zn | Cs2[Zn(H2O)6](SO4)2 | Sulfato de cesio y zinc hexahidrato[59] | 9.314(2) | 12.817(2) | 6.369(2) | 106.94(2)° | 727.3 | Incoloro[15] | 1.507 | 1.610 | 1.615 | biaxial(-) | grande | densidad=2.881 [60] |
| NH4 | Zn | (NH4)2[Zn(H2O)6](SO4)2 | 9.205 | 12.475 | 6.225 | 106°52′[16] | 684.1 | Calor de fusión: 285 J/g[61] | |||||||
| Tl | Zn | Tl2[Zn(H2O)6](SO4)2 | Sulfato de hexaaquazinc de talio[62] | 9.219(2) | 12.426(2) | 6.226(1) | 106.29(2)° | 684.6 | Incoloro[19] | ||||||
| Selenatos | |||||||||||||||
| Cs | Ni | Cs2[Zn(H2O)6](SeO4)2 | Selenato de dicesio y níquel hexahidrato[63] | 7.4674 | 7.9152 | 11.7972 | 106.363 | 669.04 | Verde brillante | ||||||
| Rb | Cu | Rb2[Cu(H2O)6](SeO4)2 | Selenato de cobre y dirubidio hexahidrato[64] | 6.363 | 12.431 | 9.373 | 104.33 | 718.3 |
Sales orgánicas
Algunas bases orgánicas también pueden formar sales que cristalizan como las sales de Tutton.
| fórmula | nombre | a Å | b Å | c Å | β° | V Å3 | color |
|---|---|---|---|---|---|---|---|
| (C4H12N2)[Zn(H2O)6](SO4)2 | Bis(sulfato) de hexaaquazinc de piperazinadio[65] | 12.9562 | 10.6502 | 13.3251 | 114.032 | 1679.30 | Incoloro |
| Sulfato de cadmio y creatinina[66] | 6.5584 | 27.871 | 7.1955 | 110.371 | 1232.99 | Incoloro |
Referencias
- ↑ Ettoumi, Houda; Bulou, Alain; Suñol, Joan Josep; Mhiri, Tahar (November 2015). «Synthesis, crystal structure, and vibrational study of : A new metal hydrogenphosphate compound». Journal of Molecular Structure 1099: 181-188. Bibcode:2015JMoSt1099..181E. doi:10.1016/j.molstruc.2015.06.060.
- ↑ Bosi, Ferdinando; Belardi, Girolamo; Ballirano, Paolo (2009). «Structural features in Tutton's salts K2[M2+(H2O)6](SO4)2, with M2+ = Mg, Fe, Co, Ni, Cu, and Zn». American Mineralogist 94 (1): 74-82. Bibcode:2009AmMin..94...74B. doi:10.2138/am.2009.2898.
- ↑ B. N. Figgis; E. S. Kucharski; P. A. Reynolds; F. Tasset (1989). «The structure of at 4.3 K by neutron diffraction». Acta Crystallogr. C45: 942-944. doi:10.1107/S0108270188013903.
- ↑ Taylor, F. Sherwood (1942). Inorganic and Theoretical Chemistry (6th edición). William Heinemann.
- ↑ A. E. Tutton (1900–1901). «A Comparative Crystallographical Study of the Double Selenates of the Series .
Salts in Which M Is Zinc». Proceedings of the Royal Society of London 67 (435–441): 58-84. doi:10.1098/rspl.1900.0002. - ↑ Nyquist, Richard A.; Kagel, Ronald O. (30 de marzo de 1972). Handbook of Infrared and Raman Spectra of Inorganic Compounds and Organic Salts: Infrared Spectra of Inorganic Compounds. Academic Press. pp. 297-298. ISBN 9780080878522. Consultado el 18 de junio de 2013. (also includes Ni Cu )
- ↑ Lakshman, S.V.J.; T.V.Krishna Rao (1984). «Absorption spectrum of ion doped in caesium cadmium sulphate hexahydrate single crystal». Solid State Communications 49 (6): 567-570. Bibcode:1984SSCom..49..567L. ISSN 0038-1098. doi:10.1016/0038-1098(84)90193-5.
- ↑ a b c Swanson, H. E.; H. F. McMurdie; M. C. Morris; E. H. Evans (September 1970). «Standard X-ray Diffraction Powder Patterns». National Bureau of Standards Monograph 25 Section 8. National Bureau of Standards. Consultado el 16 de junio de 2013.
- ↑ «materials database». Atom Work. Consultado el 2 de julio de 2015.
- ↑ a b «Materials Database». Atom Work. Consultado el 2 de julio de 2015.
- ↑ a b c Ananthanarayanan, V. (1961). «Raman spectra of crystalline double sulphates». Zeitschrift für Physik 163 (2): 144-157. Bibcode:1961ZPhy..163..144A. ISSN 1434-6001. S2CID 120815961. doi:10.1007/BF01336872.
- ↑ a b c d e f g h i j Bosi, F.; G. Belardi; P. Ballirano (2009). «Structural features in Tutton's salts , with ». American Mineralogist 94 (1): 74-82. Bibcode:2009AmMin..94...74B. ISSN 0003-004X. S2CID 97302855. doi:10.2138/am.2009.2898.
- ↑ «materials database». Atom Work. Consultado el 2 de julio de 2015.
- ↑ Krebs, Robert E. (1 de enero de 2006). The History And Use of Our Earth's Chemical Elements: A Reference Guide. Greenwood Publishing Group. p. 59. ISBN 9780313334382. Consultado el 17 de junio de 2013.
- ↑ a b c d e f Euler, H.; B. Barbier; A. Meents; A. Kirfel (2003). «Crystal structure of Tutton's salts, , ». Zeitschrift für Kristallographie. New Crystal Structures 218 (4): 409-413. ISSN 1433-7266. doi:10.1524/ncrs.2003.218.4.409. Consultado el 15 de junio de 2013.
- ↑ a b c Ananthanarayanan, V. (June 1962). «Raman spectra of crystalline double sulphates Part II. Ammonium double sulphates». Zeitschrift für Physik 166 (3): 318-327. Bibcode:1962ZPhy..166..318A. S2CID 123224200. doi:10.1007/BF01380779.
- ↑ «Materials database». Atom Work.
- ↑ Lim, Ae Ran (2011). «Thermodynamic properties and phase transitions of Tutton salt crystals». Journal of Thermal Analysis and Calorimetry 109 (3): 1619-1623. ISSN 1388-6150. S2CID 95478618. doi:10.1007/s10973-011-1849-2.
- ↑ a b c d e f Euler, Harald; Bruno Barbier; Alke Meents; Armin Kirfel (2009). «Crystal structures of Tutton′s salts , ». Zeitschrift für Kristallographie - New Crystal Structures 224 (3): 355-359. ISSN 1433-7266. doi:10.1524/ncrs.2009.0157.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 70. Consultado el 17 de junio de 2013.
- ↑ a b c Dobe, Christopher; Christopher Noble; Graham Carver; Philip L. W. Tregenna-Piggott; Garry J. McIntyre; Anne-Laure Barra; Antonia Neels; Stefan Janssen et al. (2004). «Electronic and Molecular Structure of High-Spin d4 Complexes: Experimental and Theoretical Study of the [Cr(D2O)6]2+Cation in Tutton's Salts». Journal of the American Chemical Society 126 (50): 16639-16652. Bibcode:2004JAChS.12616639D. ISSN 0002-7863. PMID 15600370. doi:10.1021/ja046095c.
- ↑ Dobe, Christopher; Hans-Peter Andres; Philip L.W. Tregenna-Piggott; Susanne Mossin; Høgni Weihe; Stefan Janssen (2002). «Variable temperature inelastic neutron scattering study of chromium(II) Tutton salt: manifestation of the 5E ⊗ e Jahn–Teller effect». Chemical Physics Letters 362 (5–6): 387-396. Bibcode:2002CPL...362..387D. ISSN 0009-2614. doi:10.1016/S0009-2614(02)01131-4.
- ↑ a b c «materials database». Consultado el 2 de julio de 2015.
- ↑ Zhou, Dawei; R. W. Kreilick (1993). «Electron spin exchange in single crystals of copper Tutton's salt ()». The Journal of Physical Chemistry 97 (37): 9304-9310. ISSN 0022-3654. doi:10.1021/j100139a009.
- ↑ a b Ballirano, Paolo; Girolamo Belardi (2007). «Rietveld refinement of the Tutton's salt from parallel-beam X-ray powder diffraction data». Acta Crystallographica Section E 63 (2): i56-i58. ISSN 1600-5368. doi:10.1107/S1600536807002656.
- ↑ Ballirano, Paolo; Girolamo Belardi; Ferdinando Bosi (2007). «Redetermination of the Tutton's salt ». Acta Crystallographica Section E 63 (7): i164-i165. ISSN 1600-5368. doi:10.1107/S1600536807029790.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H.. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 14. Consultado el 17 de junio de 2013.
- ↑ a b Simmons, Charles J.; Michael A. Hitchman; Horst Stratemeier; Arthur J. Schultz (1993). «High-pressure, low-temperature, single-crystal neutron diffraction study of deuterated and hydrogenous ammonium hexaaquacopper(II) sulfate (Tutton's salt): a pressure-switchable Jahn-Teller distortion». Journal of the American Chemical Society 115 (24): 11304-11311. Bibcode:1993JAChS.11511304S. ISSN 0002-7863. doi:10.1021/ja00077a032.
- ↑ a b c «976 Diammonium hexaquacopper(ii) sulfate () (ICSD 62991)». openmopac. Consultado el 2 de julio de 2015.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H.. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 72. Consultado el 17 de junio de 2013.
- ↑ Swanson, H. E.; H. F. McMurdie; M. C. Morris; E. H. Evans (September 1970). «Standard X-ray Diffraction Powder Patterns». National Bureau of Standards Monograph 25 Section 8. National Bureau of Standards. p. 64. Consultado el 16 de junio de 2013.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 14. Consultado el 17 de junio de 2013.
- ↑ «Mohrite». Mineral Data Publishing. Consultado el 17 de junio de 2013.
- ↑ Swanson, H. E.; H. F. McMurdie; M. C. Morris; E. H. Evans (September 1970). «Standard X-ray Diffraction Powder Patterns». National Bureau of Standards Monograph 25 Section 8. National Bureau of Standards. p. 87. Consultado el 16 de junio de 2013.
- ↑ Swanson, H. E.; H. F. McMurdie; M. C. Morris; E. H. Evans (September 1970). «Standard X-ray Diffraction Powder Patterns». National Bureau of Standards Monograph 25 Section 8. National Bureau of Standards. p. 54. Consultado el 16 de junio de 2013.
- ↑ Somasekharam, V.; Y.P. Reddy (1985). «Spectroscopic studies on vanadyl ion in rubidium magnesium sulphate hexahydrate». Solid State Communications 53 (8): 695-697. Bibcode:1985SSCom..53..695S. ISSN 0038-1098. doi:10.1016/0038-1098(85)90380-1.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1970). Standard X-ray Diffraction Powder Patterns: Section 8. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 70. Consultado el 17 de junio de 2013.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 18. Consultado el 17 de junio de 2013.
- ↑ Chand, Prem; R. Murali Krishna; J. Lakshmana Rao; S. V. J. Lakshman (1993). «EPR and optical studies of vanadyl complexes in two host-crystals of Tutton salts of thallium». Radiation Effects and Defects in Solids 127 (2): 245-254. Bibcode:1993REDS..127..245C. ISSN 1042-0150. doi:10.1080/10420159308220322.
- ↑ [=60195 «ICSD for WWW»]. Consultado el 15 de junio de 2013.
- ↑ Euler, H.; B. Barbier; S. Klumpp; A. Kirfel (2000). «Crystal structure of Tutton's salts, , ». Zeitschrift für Kristallographie. New Crystal Structures 215 (4): 473-476. ISSN 1433-7266. doi:10.1515/ncrs-2000-0408. Consultado el 15 de junio de 2013.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 20. Consultado el 17 de junio de 2013.
- ↑ Montgomery, H.; R. V. Chastain; E. C. Lingafelter (1966). «The crystal structure of Tutton's salts. V. Manganese ammonium sulfate hexahydrate». Acta Crystallographica 20 (6): 731-733. Bibcode:1966AcCry..20..731M. ISSN 0365-110X. doi:10.1107/S0365110X66001762.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1970). Standard X-ray Diffraction Powder Patterns: Section 8. Data for 81 Substances. Washington D.C. p. 12. Consultado el 17 de junio de 2013.
- ↑ Nalbandyan, V. B. (29 de febrero de 2012). «Thallium manganese sulfate hexahydrate, a missing Tutton's salt, and a brief review of the entire family». Powder Diffraction 23 (1): 52-55. Bibcode:2008PDiff..23...52N. S2CID 97043497. doi:10.1154/1.2840634.
- ↑ a b Wang, Xia; Xinxin Zhuang; Genbo Su; Youping He (2008). «A new ultraviolet filter: (RNSH) single crystal». Optical Materials 31 (2): 233-236. Bibcode:2008OptMa..31..233W. ISSN 0925-3467. doi:10.1016/j.optmat.2008.03.020.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 23. Consultado el 17 de junio de 2013.
- ↑ Montgomery, H.; E.C. Lingafelter (10 de noviembre de 1964). «The crystal structure of Tutton's salts. II. Magnesium ammonium sulfate hexahydrate and nickel ammonium sulfate hexahydrate». Acta Crystallographica (International Union of Crystallography) 17 (11): 1478. Bibcode:1964AcCry..17.1478M. doi:10.1107/s0365110x6400367x.
- ↑ Morris, Marlene C; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Hubbard, Camden R.; Carmel, Simon J. (1980). «Standard X-ray Diffraction Powder Patterns: Section 17. Data for 54 Substances». Final Report National Bureau of Standards. Bibcode:1980nbs..reptR....M.
- ↑ «The Monoclinic Double Sulphates Containing Ammonium. Completion of the Double Sulphate Series». January 1916.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 78. Consultado el 17 de junio de 2013.
- ↑ a b Bernhard, Paul; Ludi, Andreas (March 1984). «Infrared and Raman spectra of the hexaaquaruthenium ions: normal-coordinate analysis for and ». Inorganic Chemistry 23 (7): 870-872. doi:10.1021/ic00175a015.
- ↑ Mido, M. Satake & Y.; Satake, M. (1 de enero de 2010). Chemistry Of Transition Elements. Discovery Publishing House. p. 43. ISBN 9788171412433. Consultado el 17 de junio de 2013.
- ↑ Montgomery, H.; B. Morosin; J. J. Natt; A. M. Witkowska; E. C. Lingafelter (1967). «The crystal structure of Tutton's salts. VI. Vanadium(II), iron(II) and cobalt(II) ammonium sulfate hexahydrates». Acta Crystallographica 22 (6): 775-780. Bibcode:1967AcCry..22..775M. ISSN 0365-110X. doi:10.1107/S0365110X67001550.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 43. Consultado el 17 de junio de 2013.
- ↑ Lim, Ae Ran; Kim, Sun Ha (23 de julio de 2015). «Structural and thermodynamic properties of Tutton salt K2Zn(SO4)2·6H2O». Journal of Thermal Analysis and Calorimetry 123 (1): 371-376. S2CID 93389171. doi:10.1007/s10973-015-4865-9.
- ↑ Somasekharam, V; Prasad, P Siva; Ramesh, K; Reddy, Y P (1 de febrero de 1986). «Electronic Spectra of VO and Cu Ions in Rubidium Zinc Sulphate Hexahydrate». Physica Scripta 33 (2): 169-172. Bibcode:1986PhyS...33..169S. S2CID 250762626. doi:10.1088/0031-8949/33/2/014.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 55. Consultado el 17 de junio de 2013.
- ↑ Lakshmana Rao, J.; K. Purandar (1980). «Absorption spectrum of in zinc cesium sulphate hexahydrate». Solid State Communications 33 (3): 363-364. Bibcode:1980SSCom..33..363L. ISSN 0038-1098. doi:10.1016/0038-1098(80)91171-0.
- ↑ Swanson, H. E.; McMurdie, H. F.; Morris, M. C.; Evans, E. H. (September 1969). Standard X-ray Diffraction Powder Patterns: Section 7. Data for 81 Substances. Washington D.C: UNT Digital Library. p. 25. Consultado el 17 de junio de 2013.
- ↑ Voigt, W.; S. Göring (1994). «Melting of Tutton's salts studied by DSC». Thermochimica Acta 237 (1): 13-26. Bibcode:1994TcAc..237...13V. ISSN 0040-6031. doi:10.1016/0040-6031(94)85179-4.
- ↑ Chand, Prem; Krishna, R. Murali; Rao, J. Lakshmana; Lakshman, S. V. J. (November 1993). «EPR and optical studies of vanadyl complexes in two host-crystals of Tutton salts of thallium». Radiation Effects and Defects in Solids 127 (2): 245-254. Bibcode:1993REDS..127..245C. doi:10.1080/10420159308220322.
- ↑ Yankova, Rumyana; Genieva, Svetlana (June 2019). «Crystal structure and IR investigation of double salt Cs2Ni(SeO4)2·4H2O». Chemical Data Collections 21: 100234. S2CID 181399910. doi:10.1016/j.cdc.2019.100234.
- ↑ Yankova, Rumyana (May 2020). «Hirshfeld surface analysis and ir investigation for the rubidium hexaaquacopper(II) selenate». Chemical Data Collections (en inglés) 27: 100379. S2CID 218940437. doi:10.1016/j.cdc.2020.100379.
- ↑ Rekik, Walid; Naïli, Houcine; Mhiri, Tahar; Bataille, Thierry (April 2005). «Piperazinediium hexaaquazinc(II) bis(sulfate): A structural analogue of Tutton's salts». Acta Crystallographica Section E 61 (4): m629. Bibcode:2005AcCrE..61M.629R. doi:10.1107/s1600536805005982.
- ↑ Colaneri, Michael J.; Teat, Simon J.; Vitali, Jacqueline (20 de febrero de 2020). «Electron Paramagnetic Resonance Characteristics and Crystal Structure of a Tutton Salt Analogue: Copper-Doped Cadmium Creatininium Sulfate». The Journal of Physical Chemistry A 124 (11): 2242-2252. Bibcode:2020JPCA..124.2242C. OSTI 1777953. PMID 32078331. S2CID 211231042. doi:10.1021/acs.jpca.0c00004.