SPME
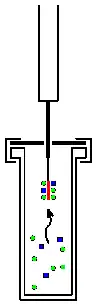
Microextracción en fase sólida (MEFS) o SPME (por sus siglas en inglés) es una técnica utilizada en el análisis químico para extraer diferentes sustancias para su posterior identificación. Habitualmente se utiliza una fibra de sílice fundida cubierta con un material polimérico no volátil que permite la extracción de analitos orgánicos directamente de muestras, acuosas o gaseosas y que posteriormente pueden ser desorbidas y analizadas mediante técnicas cromatográficas. La fibra extractora se monta en un soporte que es muy parecido a una jeringa ordinaria. Esta técnica combina al muestreo y a la preconcentración de la muestra en un solo paso.[1] Fue desarrollada a principios de los años noventa por el equipo del Dr. J. Pawliszyn en la Universidad de Waterloo.[2]Esta técnica novedosa y relativamente económica se puede implementar tanto en el laboratorio como en el campo y no requiere el uso de solventes.
Fundamento
La técnica de microextracción en fase sólida (SPME) se basa en la retención de los analitos de la muestra en un material sorbente y su posterior desorción para análisis cromatográfico. En el caso de esta técnica de extracción y análisis, el término sorbente implica el empleo tanto de mecanismos de adsorción como de absorción durante el proceso de extracción de los analitos. El material sorbente puede estar dispuesto en una fibra, en una barra, o en un tubo. La forma habitual se basa en el empleo de una fibra de sílice fundida, de aproximadamente un cm de longitud, recubierta del material sorbente en la que se retienen los analitos con posterior desorción y determinación mediante cromatografía de gases (también mediante HPLC). La fibra con su recubrimiento se montan sobre un soporte rígido, protegida por una aguja similar a las hipodérmicas, cuya función, además de la protectora, es la de permitir perforar el cierre de goma de silicona del inyector en el cromatógrafo de gases.[3]El material sorbente puede estar formado por un polímero líquido fuertemente unido a un soporte sólido (fase ligada), en cuyo caso predomina la extracción mediante mecanismos de absorción y reparto o un adsorbente sólido de alta porosidad, con lo que el mecanismo predominante para la separación del soluto es la adsorción. Esta capa puede extraer diferentes tipos de moléculas, volátiles o no volátiles, de diferentes tipos de medios en fase líquida o gaseosa. La cantidad de moléculas extraídas por la fibra es proporcional a su concentración en la muestra y depende del valor de la constante de equilibrio (coeficiente de partición o relación de distribución) del analito entre la muestra y el material que recubre la fibra; siempre y cuando se alcance el equilibrio termodinámico. En caso de que la extracción se realice en tiempos cortos la agitación manual de la muestra acelera el proceso de extracción.[4]
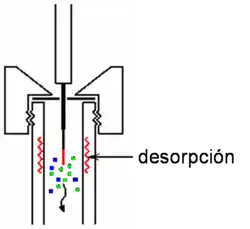
El procedimiento operatorio consiste en introducir la fibra en la muestra líquida o en un espacio-cabeza durante el tiempo necesario para asegurar que se establece el equilibrio entre los solutos orgánicos adsorbidos y los presentes en la muestra. Una vez transcurrido el tiempo de muestreo, la fibra es transferida al puerto de inyección del instrumento de separación (generalmente un aparato de cromatografía de gases, aunque también puede ser un cromatógrafo de líquidos de alta eficacia, HPLC), donde la desorción de las moléculas tiene lugar, pasando los analitos en la fase móvil, para su separación y análisis.[5] En SPME, los analitos no se extraen cuantitativamente de la matriz, pero si se mantienen las condiciones de presión, temperatura y volumen de muestra, la cantidad de soluto determinada para cada analito es proporcional a la concentración de estos en la muestra, siempre que se alcance el equilibrio entre la fase sólida y la muestra. Si el mecanismo predominante es la absorción, esta proporcionalidad se puede expresar mediante una ecuación lineal:
donde n es la cantidad de analito absorbido; C0 la concentración de analito en la muestra; VF el volumen de recubrimiento de la fibra y Keq la constante de equilibrio (o distribución fibra/disolución)
donde CF corresponde a la concentración de analito en el material sorbente de la fibra y Cm la concentración en la muestra. Obviamente, cuanto mayor sea la constante de distribución, Keq mayor es la cantidad de analito absorbido en la fibra. Para volúmenes grandes de muestra, la cantidad de analito retenido no depende del volumen de muestra. En consecuencia, la técnica es ideal para muestreo in situ en medio ambiente, por ejemplo en espacios de aire abiertos o en agua de lagos. El tiempo necesario para alcanzar el equilibrio se puede reducir sometiendo la fibra (o la muestra líquida) a agitación. También mediante control de la temperatura, fuerza iónica o pH.[3]
Características de la fibra
La fibra utilizada para la extracción en fase sólida suele tener una longitud entre uno y dos centímetro y el volumen de sorbente que recubre dicha fibra de sílice fundida suele ser inferior a un μL, con espesores oscilando típicamente entre 7 y 100 µm. Cuanto mayor es el espesor, mayor es la cantidad de analito retenido. Espesores gruesos se usan para retener compuestos más volátiles. El empleo de espesores finos presentan la ventaja de que la desorción es más completa y rápida. Respecto a al sorbente o fase extractora, esta se asemeja a la fase estacionaria empleada en cromatografía de gases; es decir polímeros líquidos de alto peso molecular unidos químicamente a la fibra, aunque también se pueden utilizar sorbentes sólidos de alta porosidad.[4]En la actualidad existen muchos recubrimientos de fibra SPME disponibles comercialmente que son combinaciones de polidimetilsiloxano, divinilbenceno, carboxeno, poliacrilato y polietilenglicol, [6][7] lo que permite seleccionar la fibra más adecuada para cada caso, teniendo en cuenta que la capa absorbente debe tener una alta afinidad por los analitos objeto del análisis. En general, la polaridad de los analitos debe ser similar a la de la fibra usada; es decir, analitos poco polares se retienen mejor sobre fibras no polares y viceversa. Dependiendo de las características de los analitos de interés, ciertas propiedades del recubrimiento mejoran la extracción, como la polaridad, el espesor y el área de superficie.[8] Así, las estructuras poliméricas aumentan la superficie y por consiguiente, la eficacia de retención; por ejemplo, el polietilenglicol sobre polímero de divinilbenceno aumenta la eficacia de extracción de moléculas polares pequeñas.[3] Por último, la matriz de la muestra también puede influir en la adecuada selección del recubrimiento de la fibra. Según el tipo de muestra y los analitos de interés, es posible que la fibra deba tolerar la inmersión directa en ella.[6]

El método de MEFS resulta muy atractivo pues la extracción se realiza de manera rápida y puede ser llevada a cabo sin necesidad de utilizar solventes. Además el umbral de detección pueden estar en el orden de partes por trillón (ppt). La MEFS posee un gran potencial en aplicaciones en el campo: el muestreo se puede llevar a cabo en lugares remotos sin necesidad de que el personal tenga un alto nivel de experticia. Cuando las muestras son almacenadas de manera adecuada, estas pueden ser analizadas días después del muestreo sin perder cantidades significativas de los compuestos en cuestión.[9]
Véase también
Referencias
- ↑ Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch. (2015). Fundamentos de química analítica. Cengage Learning. p. 857. ISBN 978-607-519-937-6.
- ↑ Arthur, Catherine L.; Pawliszyn, Janusz. (1 de octubre de 1990). «Solid phase microextraction with thermal desorption using fused silica optical fibers». Analytical Chemistry (en inglés) 62 (19): 2145-2148. ISSN 0003-2700. doi:10.1021/ac00218a019. Consultado el 25 de enero de 2025.
- ↑ a b c Polo Díez, Luis M. (2015). «Cap. 8.6. Microextracción en fase sólida (SPME)». Fundamentos de cromatografía. Madrid: Dextra Editorial. ISBN 978-84-16277-58-2.
- ↑ a b Pawliszyn, Janusz (1999). «Chap. 1. Quantitative Aspects of SPME». Applications of solid phase microextraction. RSC chromatography monographs (en inglés). Royal Society of Chemistry. ISBN 978-0-85404-525-9. Consultado el 25 de enero de 2025.
- ↑ Zhang, Chunlong (2007). «Chap. 7.3.3. Solid Phase Microextraction». Fundamentals of environmental sampling and analysis (en inglés). Wiley-Interscience. ISBN 978-0-471-71097-4. Consultado el 25 de enero de 2025.
- ↑ a b Reyes-Garcés, Nathaly; Gionfriddo, Emanuela; Gómez-Ríos, German Augusto; Alam, Md. Nazmul; Boyacı, Ezel; Bojko, Barbara; Singh, Varoon; Grandy, Jonathan et al. (2 de enero de 2018). «Advances in Solid Phase Microextraction and Perspective on Future Directions». Analytical Chemistry (en inglés) 90 (1): 302-360. ISSN 0003-2700. doi:10.1021/acs.analchem.7b04502. Consultado el 27 de enero de 2025.
- ↑ Kumar, Ashwini; Gaurav; Malik, Ashok Kumar; Tewary, Dhananjay Kumar; Singh, Baldev (2008-03). «A review on development of solid phase microextraction fibers by sol–gel methods and their applications». Analytica Chimica Acta (en inglés) 610 (1): 1-14. doi:10.1016/j.aca.2008.01.028. Consultado el 27 de enero de 2025.
- ↑ Spietelun, Agata; Pilarczyk, Michał; Kloskowski, Adam; Namieśnik, Jacek (2010). «Current trends in solid-phase microextraction (SPME) fibre coatings». Chemical Society Reviews (en inglés) 39 (11): 4524. ISSN 0306-0012. doi:10.1039/c003335a. Consultado el 27 de enero de 2025.
- ↑ Verma, Neeraj; Arya, Nikhilesh; Singh, Varoon (2025). Solid-phase microextraction (en inglés). Elsevier. pp. 79-112. ISBN 978-0-443-13907-9. doi:10.1016/b978-0-443-13907-9.00005-x. Consultado el 26 de enero de 2025.
Otra bibliografía
- Pawliszyn J (1997) Solid Phase Microextraction: theory and practice, Wiley-VCH
- Peñalver A (2002) Aplicación de la microextracción en fase sólida al análisis medioambiental. Memoria presentada para optar al grado de Doctora en Química, UNIVERSITAT ROVIRA I VIRGILI, Tarragona, España. disponible (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
Enlaces externos