Química del organorutenio
La química del organorutenio es la química de los compuestos organometálicos que contienen un enlace químico de carbono a rutenio. Varios catalizadores de organorutenio son de interés comercial[1] y se han considerado compuestos de organorutenio para la terapia del cáncer.[2] La química tiene algunas similitudes estequiométricas con la química del organohierro, ya que el hierro está directamente encima del rutenio en el grupo 8 de la tabla periódica. Los reactivos más importantes para la introducción de rutenio son el cloruro de rutenio(III) y el dodecacarbonilo de trirutenio.
Se sabe que en sus compuestos organometálicos, el rutenio adopta estados de oxidación de −2 ([Ru(CO)4] 2−) a +6 ([RuN(Me)4]−). Los más comunes son aquellos en el estado de oxidación +2, como se ilustra a continuación.
-
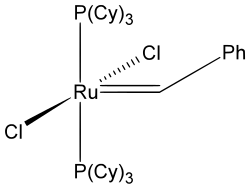 Catalizador Grubbs de primera generación
Catalizador Grubbs de primera generación -
 Catalizador de Shvo
Catalizador de Shvo -
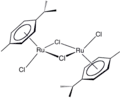 Dímero de dicloruro de (cimeno)rutenio
Dímero de dicloruro de (cimeno)rutenio -
-
bis(triphenylphosphine)ruthenium.png) Cloro(ciclopentadienil)bis(trifenilfosfina)rutenio
Cloro(ciclopentadienil)bis(trifenilfosfina)rutenio -
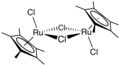 Dímero de dicloruro de pentametilciclopentadienil rutenio
Dímero de dicloruro de pentametilciclopentadienil rutenio
Ligandos
Al igual que otros metales de transición tardía, el rutenio se une más favorablemente con ligandos blandos.[3] Los ligandos más importantes para el rutenio son:
- haluros, especialmente cloruro.
- fosfinas, especialmente trifenilfosfina.
- Carbenos N-heterocíclicos (NHC).
- ligandos de ciclopentadienilo.
- varios arenos y dienos
- monóxido de carbono.
- hidruro, especialmente en el catalizador Shvo.
- carburos metálicos, especialmente en el catalizador de Grubbs.
Ligandos de fosfina
Si bien los ligandos de fosfina monodentados, como la trifenilfosfina y la triciclohexilfosfina, son los más comunes, los ligandos de fosfina bidentados también pueden ser útiles en compuestos de organorutenio. El BINAP, en particular, es un ligando asimétrico útil para muchos catalizadores de rutenio asimétricos.
Ligandos de carbeno N-heterocíclico
Los ligandos NHC se han vuelto muy comunes en los complejos de organorutenio.[4][5] Los ligandos NHC se pueden preparar con parámetros estéricos y electrónicos precisos y pueden ser quirales para su uso en catálisis asimétrica.[6] Los NHC, como ligandos de tipo L fuertemente donantes, se utilizan a menudo para reemplazar a los ligandos de fosfina. Un ejemplo notable es el catalizador Grubbs de segunda generación, en el que una fosfina del catalizador de primera generación se reemplaza por un NHC.
Ligandos de ciclopentadienilo
El compuesto parental, el rutenoceno, no es reactivo porque está saturado coordinativamente y no contiene grupos reactivos. El catalizador Shvo ([Ph4(η5-C4CO)]2H]}Ru2(CO)4(μ-H)) también está saturado coordinativamente, pero presenta grupos OH y RuH reactivos que le permiten funcionar en la hidrogenación por transferencia.[7] Se utiliza en la hidrogenación de aldehídos, cetonas, hidrogenación por transferencia, en la desproporción de aldehídos a ésteres y en la isomerización de alcoholes alílicos.
El cloro(ciclopentadienil)bis(trifenilfosfina)rutenio presenta un grupo cloro reactivo, que se sustituye fácilmente por sustratos orgánicos.
Ligandos areno y alqueno
Un ejemplo de un complejo de Ru-areno es el dímero de dicloruro de (cimeno)rutenio, que es el precursor de un catalizador versátil para la hidrogenación por transferencia. El acenaftileno forma un catalizador útil derivado del dodecacarbonilo de trirutenio. La hapticidad del ligando de hexametilbenceno en Ru(C6Me6)2 depende del estado de oxidación del centro metálico:[8] El compuesto Ru(COD)(COT) es capaz de dimerizar norbornadieno:

Se han investigado los complejos multinucleares de organo-rutenio por sus propiedades anticancerígenas. Los compuestos estudiados incluyen complejos di-, tri- y tetra-nucleares y jaulas tetra-, hexa- y octa-metala-nucleares.[2]
Carbonilos
El principal carbonilo de rutenio es el dodecacarbonilo de trirutenio, Ru3(CO)12. Los análogos de los reactivos populares Fe(CO)5 y Fe2(CO)9 no son muy útiles. El pentacarbonil de rutenio se descarbonila fácilmente:
- Ru3(CO)12 + 3 CO
 3 Ru(CO)5
3 Ru(CO)5
La carbonilación del tricloruro de rutenio da una serie de clorocarbonilos Ru(II). Estos son los precursores del Ru3(CO)12.
Referencias
- ↑ Synthesis of Organometallic Compounds: A Practical Guide Sanshiro Komiya Ed. S. Komiya, M. Hurano 1997.
- ↑ a b Babak, Maria V.; Wee, Han Ang (2018). «Chapter 6. Multinuclear Organometallic Ruthenium-Arene Complexes for Cancer Therapy». En Sigel, Astrid; Sigel, Helmut, eds. Metallo-Drugs:Development and Action of Anticancer Agents. Metal Ions in Life Sciences 18. Berlin: de Gruyter GmbH. pp. 171-198. PMID 29394025. doi:10.1515/9783110470734-012.
- ↑ Barthazy, P.; Stoop, R. M.; Wörle, M.; Togni, A.; Mezzetti, A. (2000). «Toward Metal-Mediated C-F Bond Formation. Synthesis and Reactivity of the 16-Electron Fluoro Complex [RuF(dppp)2]PF6 (dppp = 1,3-Bis(diphenylphosphino)propane)». Organometallics 19: 2844-2852. doi:10.1021/om0000156.
- ↑ Öfele, K.; Tosh, E.; Taubmann, C.; Herrmann, W.A. (2009). «Carbocyclic Carbene Metal Complexes». Chemical Reviews 109 (8): 3408-3444. PMID 19449832. doi:10.1021/cr800516g.
- ↑ Samojłowicz, C.; Bieniek, M.; Grela, K. (2009). «Ruthenium-Based Olefin Metathesis Catalysts Bearing N-Heterocyclic Carbene Ligands». Chemical Reviews 109 (8): 3708-3742. PMID 19534492. doi:10.1021/cr800524f.
- ↑ Benhamou, L.; Chardon, E.; Lavigne, G.; Bellemin-Laponnaz, S.; César, V. (2011). «Synthetic Routes to N-Heterocyclic Carbene Precursors». Chemical Reviews 111 (12): 2705-2733. PMID 21235210. doi:10.1021/cr100328e.
- ↑ Conley, B.; Pennington-Boggio, M.; Boz, E.; Williams, T. (2010). «Discovery, Applications, and Catalytic Mechanisms of Shvo's Catalyst». Chemical Reviews 110 (4): 2294-2312. PMID 20095576. doi:10.1021/cr9003133.
- ↑ Huttner, Gottfried; Lange, Siegfried; Fischer, Ernst O. (1971). «Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0)». Angewandte Chemie International Edition 10 (8): 556-557. doi:10.1002/anie.197105561.