Perclorato de sodio
| Perclorato de sodio | ||
|---|---|---|
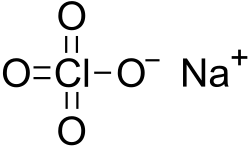 | ||
| Nombre IUPAC | ||
| Perclorato de sodio | ||
| General | ||
| Otros nombres | Perclorato sódico | |
| Fórmula estructural | Estructura en Jmol | |
| Fórmula molecular | NaClO4 | |
| Identificadores | ||
| Número CAS | 7601-89-0[1] | |
| Número RTECS | SC9800000 | |
| ChEMBL | CHEMBL1644700 | |
| ChemSpider | 22668 | |
| PubChem | 522606 | |
| Propiedades físicas | ||
| Apariencia | Polvo o cristales blanco | |
| Densidad | 2499,4 kg/m³; 2,4994 g/cm³ | |
| Masa molar | 122,44 g/mol | |
| Punto de descomposición | 755,15 K (482 °C) | |
| Estructura cristalina | Rómbica | |
| Propiedades químicas | ||
| Solubilidad en agua | 209.6 g/100 ml | |
| Termoquímica | ||
| ΔfH0sólido | −382,75 kJ/mol | |
| S0sólido | 142,26 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 673 K (400 °C) | |
| NFPA 704 |
0
2
2
| |
| Frases R | R9 R22 | |
| Frases S | (S2) S13 S22 S27 | |
| Riesgos | ||
| Ingestión | Enjuagar la boca, atención médica. | |
| Inhalación | Tos, dolor de garganta. Dar aire limpio, reposo, atención médica. | |
| Piel | Enrojecimiento. Quitar ropas contaminadas, lavar con agua y jabón. | |
| Ojos | Enrojecimiento, dolor. Enjuagar varios minutos con abundante agua, atención médica. | |
| Más información | Punto de fusión del monohidrato: 130 °C | |
| Compuestos relacionados | ||
| Otros aniones |
cloruro de sodio hipoclorito de sodio clorito de sodio clorato de sodio | |
| Otros cationes |
Perclorato de amonio Perclorato de litio Perclorato de potasio Perclorato de cesio | |
| Ácido generador | Ácido perclórico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El perclorato de sodio es el compuesto inorgánico con la fórmula NaClO4. Es la más soluble de las sales de perclorato comunes. Es un sólido cristalino blanco e higroscópico que es altamente soluble en agua y en alcohol. Usualmente se presenta como el monohidrato, que tiene una estructura cristalina rómbica.[2]
Su calor de formación es −382.75 kJ mol−1.[3]
Usos
El perclorato de sodio es el precursor de muchas otras sales de perclorato, aprovechando, en ocasiones, su baja solubilidad relativa al NaClO4 (209 g/100 ml a 25 °C). El ácido perclórico se elabora tratando el NaClO4 con HCl.
El NaClO4 encuentra un uso, aunque mínimo, en la pirotecnia y como combustible sólido para el uso de drones, debido a que es higroscópico. Para este fin se prefieren los percloratos de amonio y de potasio. Estas sales se preparan mediante una doble descomposición a partir de una disolución de perclorato de sodio y cloruros de potasio o de amonio.
Aplicaciones de laboratorio
El NaClO4 presenta diversas aplicaciones en los laboratorios, normalmente como electrolito no reactivo. Por ejemplo, se emplea en la extracción estándar del ADN y en reacciones de hibridación en biología molecular.
Producción
El perclorato de sodio se elabora por oxidación anódica del clorato de sodio, no cloruro de sodio, en un electrodo de platino.[4]
- ClO3- + H2O → ClO4- + H2
Accidentes durante su manipulación
En abril de 2025 una fuerte explosión en almacenes con percloato de sodio del puerto de Rajaee, en el sur de Irán, dejó al menos 25 muertos y más de 500 heridos, debido a un almacenamiento inadecuado.[5]
Véase también
Referencias
- ↑ Número CAS
- ↑ Eagleson, Mary (1994). Concise Encyclopedia Chemistry (en inglés). Revisada, ilustrada. Walter de Gruyter. p. 1000. ISBN 9783110114515. Consultado el 7 de marzo de 2013.
- ↑ WebBook para el NaClO4
- ↑ Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone “Chlorine Oxides and Chlorine Oxygen Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. doi 10.1002/14356007.a06_483
- ↑ «La gran explosión en Irán se originó por una mala manipulación de combustible sólido para cohetes». Euronews. 27 de abril de 2025.
Enlaces externos
- Ficha de seguridad INSST
- MSDS at Oxford University Archivado el 19 de abril de 2008 en Wayback Machine.
- WebBook para el NaClO4
