Ácidos nicotínicos
| Ácido nicotínico | ||
|---|---|---|
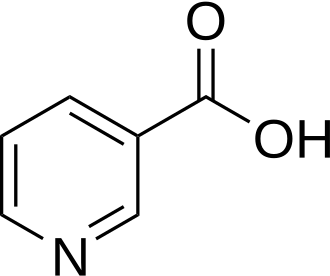 | ||
 Kekulé, fórmula esquelética del ácido nicotínico | ||
| Nombre IUPAC | ||
| Ácido 3-piridincarboxílico[1] | ||
| General | ||
| Otros nombres |
| |
| Fórmula molecular | C6H5NO2 | |
| Identificadores | ||
| Código ATC | C04AC01 C10BA01 C10AD02 C10AD52 | |
| Número CAS | 59-67-6[3] | |
| Número RTECS | QT0525000 | |
| ChEBI | 15940 | |
| ChEMBL | 573 | |
| ChemSpider | 913 | |
| DrugBank | DB00627 | |
| PubChem | 938 | |
| UNII | 2679MF687A | |
| KEGG | D00049 | |
|
OC(=O)c1cccnc1
| ||
| Propiedades físicas | ||
| Apariencia | Blanco, cristales traslucientes | |
| Densidad | 1,473 kg/m³; 0,001473 g/cm³ | |
| Índice de refracción (nD) | 1.4936 | |
| Propiedades químicas | ||
| Acidez | 2.0, 4.85 pKa | |
| Solubilidad en agua | 18 g L−1 | |
| Momento dipolar | 0.1271305813 D D | |
| log P | 0.219 | |
| Punto isoeléctrico (pH) | 4.75 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
_space_filling_model.jpg)
El ácido nicotínico,[Nota 1] también conocido como niacina,[Nota 2] es un compuesto orgánico y un vitámero de la vitamina B3, un nutriente esencial crucial para la salud humana.[4][5] Puede ser sintetizado por plantas y animales a partir del aminoácido triptófano.[6]
El ácido nicotínico también se utiliza como medicamento recetado para tratar trastornos lipídicos.[7] En dosis mucho más altas que las necesarias para fines nutricionales, reduce los triglicéridos y el colesterol de lipoproteína de baja densidad (LDL-C) en sangre, mientras aumenta el colesterol de lipoproteína de alta densidad (HDL-C, conocido como colesterol «bueno»).[7] Está disponible en formulaciones de liberación inmediata y sostenida, con dosis iniciales generalmente de 500 mg/día, que se incrementan gradualmente hasta 3000 mg/día para la forma de liberación inmediata o 2000 mg/día para la de liberación sostenida.[7] Sin embargo, a pesar de sus efectos en el perfil lipídico, no se ha demostrado que el ácido nicotínico reduzca el riesgo de enfermedad cardiovascular en pacientes que ya reciben tratamiento con estatinas.[8] Una revisión de 2010 concluyó con que el ácido nicotínico era efectivo si se toma solo,[9] pero otra revisión de 2017 encontró que, aunque el ácido nicotínico modifica los niveles lípidos, no reduce la mortalidad por todas las causas, la mortalidad cardiovascular, los infartos de miocardio ni los accidentes cerebrovasculares.[10] Además, está asociado con riesgos como hepatotoxicidad[11] y un mayor riesgo de desarrollar diabetes tipo 2.[12][13] En los Estados Unidos, las prescripciones de ácido nicotínico alcanzaron un máximo de 9.4 millones en 2009, pero disminuyeron a 800 000 en 2020.[14]
Con la fórmula química C
6H
5NO
2, el ácido nicotínico es un ácido piridincarboxílico.[5] Como precursor del dinucleótido de nicotinamida y adenina (NAD) y del fosfato de dinucleótido de nicotinamida y adenina (NADP), desempeña un papel crucial en la reparación del ADN.[15]
El ácido nicotínico ha sido detectado en fuentes extraterrestres, incluyendo condritas carbonáceas y muestras de los asteroides 162173 Ryugu y 101955 Bennu.[16][17][18]
Definición
El término «niacina» se derivó de «vitamina del ácido nicotínico» para distinguirlo de la nicotina presente en el tabaco.[19] Originalmente, se refería a la vitamina B3 como nutriente. En el inglés estadounidense, «niacina» también designa el ácido nicotínico en dosis altas utilizado como medicamento recetado.[20] En otras variantes del inglés, el medicamento se denomina exclusivamente «ácido nicotínico».[21] El término «ácido nicotínico» se refiere a la sustancia y medicina que trata la hiperlipidemia (colesterol y triglicéridos elevados) con dosis diarias de 500 a 3000 mg.[22][20] La nicotinamida en dosis altas, otro vitámero de la vitamina B3, no tiene este efecto médico.[23]
La vitamina B3 incluye varios vitámeros, como el ácido nicotínico y la nicotinamida, que pueden sustituirse mutuamente. Actúa como precursor de los coenzimas dinucleótido de nicotinamida y adenina (NAD) y fosfato de dinucleótido de nicotinamida y adenina (NADP), coenzimas de muchas deshidrogenasas y participan en numerosos procesos de transferencia de hidrógeno. El NAD es crucial para el catabolismo de grasas, carbohidratos, proteínas y alcohol, así como para la señalización celular y la reparación del ADN, mientras que el NADP participa principalmente en el anabolismo, como la síntesis de ácidos grasos y colesterol.[23] Las ingestas dietéticas recomendadas de 14–18 mg/día son suficientes para adultos sanos, según lo establecido por varios países.[6][24][25] Tanto el ácido nicotínico como la nicotinamida se utilizan para prevenir y tratar la pelagra, una enfermedad por deficiencia caracterizada por dermatitis, diarrea y demencia.[26][23]
Suplemento dietético
En los Estados Unidos, el ácido nicotínico está disponible como suplemento dietético sin receta en dosis de 100 a 1,000 mg por porción. Estos suplementos suelen incluir declaraciones de salud de estructura/función, como «Apoya un perfil lipídico sanguíneo saludable», según lo permite la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).[27] La Asociación Estadounidense del Corazón desaconseja el uso de suplementos de ácido nicotínico como sustituto de las formas recetadas debido a posibles efectos secundarios graves y a una regulación menos estricta de la FDA en la fabricación de suplementos.[28] Dosis superiores a 30 mg pueden causar rubor cutáneo, caracterizado por enrojecimiento, calor y picazón en la cara, brazos y pecho debido a la vasodilatación de pequeños vasos sanguíneos subcutáneos. Este efecto transitorio, que dura de minutos a horas, se considera generalmente desagradable pero no tóxico.[4]
Medicamento
El ácido nicotínico recetado, a menudo etiquetado como niacina en los EE. UU., está disponible en formulaciones de liberación inmediata y de liberación sostenida para tratar principalmente la hiperlipidemia primaria y la hipertrigliceridemia.[20][22] Puede usarse solo o en combinación con otros medicamentos hipolipemiantes. El tratamiento suele comenzar con 500 mg/día, con incrementos graduales hasta 3000 mg/día (liberación inmediata) o 2,000 mg/día (liberación sostenida) para lograr los cambios lipídicos deseados, incluyendo una reducción del LDL-C y los triglicéridos y un aumento del HDL-C.[20][22] Las prescripciones en los EE. UU. alcanzaron un máximo de 9,4 millones en 2009, pero cayeron a 800 000 en 2020.[14]
A pesar de estos efectos, revisiones sistemáticas indican que no se reduce la mortalidad por todas las causas, la mortalidad cardiovascular, los infartos de miocardio ni los accidentes cerebrovasculares en pacientes tratados con estatinas.[8][29] Los efectos secundarios reportados incluyen un mayor riesgo de diabetes tipo 2.[10][12][13][30]
Mecanismos
El ácido nicotínico reduce el colesterol de lipoproteína de baja densidad (LDL-C), el colesterol de lipoproteína de muy baja densidad (VLDL-C), la lipoproteína(a) y los triglicéridos, mientras aumenta el colesterol de lipoproteína de alta densidad (HDL-C).[31] Estos efectos terapéuticos lípidos están mediados en parte por la activación de receptores acoplados a proteína G, incluyendo el receptor de ácido hidroxicarboxílico 2 (HCA2) y el receptor de ácido hidroxicarboxílico 3 (HCA3), que se expresan altamente en el tejido adiposo.[32][33] Estos receptores inhiben la producción de adenosín monofosfato cíclico (AMPc), reduciendo la liberación de ácidos grasos libres (AGL) del tejido adiposo, lo que limita su disponibilidad para la síntesis hepática de lípidos circulantes.[34][35][36] La reducción de AGL también suprime la expresión hepática de apolipoproteína C3 y el coactivador-1β de PPARγ, aumentando la rotación de VLDL-C y disminuyendo su producción.[37] El ácido nicotínico inhibe directamente la diacilglicerol O-aciltransferasa 2 (DGAT2), una enzima clave en la síntesis de triglicéridos.[36]
El mecanismo encargado del aumento del HDL-C del ácido nicotínico no se comprende completamente, pero involucra múltiples mecanismos. El ácido nicotínico eleva los niveles de apolipoproteína A1 al inhibir su degradación, un componente clave de las partículas de HDL.[38][39] También inhibe la captación hepática de HDL-C al suprimir el gen de la proteína de transferencia de ésteres de colesterol (CETP).[31] Además, estimula el transportador ABCA1 en monocitos y macrófagos y regula al alza el receptor activado por proliferadores de peroxisomas gamma, promoviendo el transporte inverso de colesterol.[40]
Combinado con estatinas
El ácido nicotínico de liberación prolongada se combinó anteriormente con lovastatina (Advicor) y simvastatina (Simcor) como combinaciones de medicamentos recetados, aprobadas por la FDA en 2001 y 2008, respectivamente.[41][42][43] Ensayos clínicos posteriores mostraron que no había beneficios cardiovasculares adicionales al agregar ácido nicotínico a la terapia con estatinas.[44] En 2016, la FDA retiró la aprobación para ambas combinaciones. La razón alegada fue la siguiente: «Basándose en la evidencia colectiva de varios grandes ensayos de resultados cardiovasculares, la Agencia ha concluido que la totalidad de la evidencia científica ya no apoya la conclusión de que una reducción inducida por el fármaco en los niveles de triglicéridos y/o un aumento en los niveles de colesterol HDL en pacientes tratados con estatinas resulta en una reducción del riesgo de eventos cardiovasculares».. El fabricante posteriormente descontinuó estos medicamentos.[45]
Contraindicaciones
El ácido nicotínico recetado, tanto de liberación inmediata (Niacor) como de liberación prolongada (Niaspan), está contraindicado en personas con hepatopatía activa o antecedentes de esta, debido al riesgo de insuficiencia hepática grave y potencialmente fatal, especialmente con Niaspan.[20][46] También está contraindicado en personas con úlcera péptica u otros trastornos hemorrágicos, ya que reduce el conteo de plaquetas y afecta la coagulación sanguínea.[22][20][46] No se recomienda su uso durante el embarazo debido a datos insuficientes sobre seguridad en ensayos humanos, y está contraindicado en mujeres lactantes, ya que el ácido nicotínico se excreta en la leche materna con efectos desconocidos en los lactantes. Las altas dosis de ácido nicotínico no han sido probadas ni aprobadas para niños menores de 16 años.[22][20][46]
Efectos adversos
Los efectos adversos comunes del ácido nicotínico medicinal (500–3000 mg) incluyen rubor (calor, enrojecimiento, picazón o hormigueo en la cara, cuello y pecho), dolor de cabeza, dolor abdominal, diarrea, dispepsia, náuseas, vómitos, rinitis, prurito y erupción cutánea.[5][4][46] Estos pueden minimizarse comenzando con dosis bajas, aumentando gradualmente la dosis y evitando su suministro en ayunas.[46]
La terapia con dosis altas (1–3 g/día), comúnmente utilizada para la hiperlipidemia, puede causar efectos agudos como hipotensión, fatiga, intolerancia a la glucosa, resistencia a la insulina, acidez estomacal, visión borrosa y edema macular.[5][4] El uso prolongado (≥750 mg/día) está asociado con insuficiencia hepática, hepatitis e insuficiencia hepática aguda, particularmente con formas de liberación sostenida.[5][4] Las dosis iguales o mayores a 2 gramos por día por un tiempo prolongado aumentan significativamente el riesgo de hemorragia cerebral, accidente cerebrovascular isquémico, ulceración gastrointestinal, hemorragia gastrointestinal, diabetes, dispepsia y diarrea.[4]
Rubor
El rubor implica una vasodilatación a corto plazo de las arteriolas cutáneas, causando enrojecimiento, que generalmente dura de 15 a 30 minutos, pero puede persistir durante semanas. Afecta principalmente la cara, pero puede extenderse al cuello y pecho, impulsado por la dilatación de vasos sanguíneos[4][5] debido a niveles elevados de prostaglandina D2 (PGD2) y serotonina.[47][48][49][50] A menudo se pensaba que el rubor estaba relacionado con la histamina, pero se ha demostrado que ésta no interviene en la reacción.[47] Puede ir acompañado de una sensación de pinchazo o picazón, especialmente en áreas cubiertas por ropa.[4]
El rubor puede mitigarse alterando la vía mediada por prostaglandinas. Tomar aspirina o ibuprofeno 30 minutos antes del ácido nicotínico, consumirlo con comidas o usar formulaciones de liberación sostenida reduce este efecto.[4][51] La tolerancia se desarrolla después de varias semanas de dosificación constante, a menudo eliminando el rubor.[4] Se han desarrollado formas de ácido nicotínico de liberación lenta o «sostenida» para reducir estos efectos secundarios.[52][53] La nicotinamida y el nicotinato de inositol son formas de vitamina B3 sin rubor, aunque la eficacia del nicotinato de inositol es cuestionable.[54]
Daño hepático
Las dosis medicinales de ácido nicotínico pueden causar elevaciones modestas en las transaminasas séricas y la bilirrubina no conjugada, biomarcadores de lesión hepática, que generalmente se resuelven con el uso continuado.[11][55][56] Sin embargo, las formulaciones de liberación sostenida pueden ocasionar, en raras ocasiones, hepatotoxicidad grave, con síntomas como náuseas, vómitos, dolor abdominal, ictericia y prurito que aparecen en días o semanas. Esto se atribuye a la toxicidad directa por niveles séricos elevados de niacina. Reducir la dosis o cambiar a formas de liberación inmediata a menudo resuelve los síntomas, aunque en casos raros puede progresar a insuficiencia hepática.[11]
Diabetes
El ácido nicotínico en dosis altas para la hiperlipidemia puede elevar la glucosa en ayunas en personas con diabetes tipo 2.[12] La terapia con altas dosis de ácido nicotínico de uso prolongado también está asociado al aumento del riesgo de diabetes tipo 2 de inicio reciente.[12][13]
Otros efectos adversos
Las dosis altas pueden causar maculopatía, un engrosamiento reversible de la mácula y la retina que lleva a visión borrosa o ceguera, que se resuelve al suspender el medicamento.[57] El ácido nicotínico de liberación sostenida (Niaspan) está asociado con una reducción en el conteo de plaquetas y un aumento modesto en el tiempo de protrombina.[20]
Farmacología
Farmacodinámica
La activación del HCA2 proporciona beneficios adicionales más allá de las concentraciones séricas de colesterol y triglicéridos, también tiene efectos antioxidantes, antiinflamatorios y antitrombóticos, mejora de la función endotelial y estabilidad de la placa, todos los cuales pueden contrarrestar la progresión de la aterosclerosis.[58][59]
El ácido nicotínico inhibe las enzimas del citocromo P450 CYP2E1, CYP2D6 y CYP3A4.[60] La niacina eleva la bilirrubina no conjugada sérica en individuos sanos y en aquellos con síndrome de Gilbert, con efectos más pronunciados y prolongados en este último, lo que lo convierte en una herramienta diagnóstica para esta condición.[61][55][56]
Farmacocinética
El ácido nicotínico y la nicotinamida se absorben rápidamente en el estómago y el intestino delgado mediante difusión dependiente de sodio y pasiva.[62] La absorción permanece casi completa incluso en dosis altas (3–4 g), a diferencia de algunas vitaminas.[23] Una dosis de 1 g alcanza concentraciones plasmáticas máximas de 15–30 μg/mL en 30–60 minutos. Aproximadamente el 88% de una dosis farmacológica se excreta renalmente como ácido nicotínico sin cambios o su metabolito, ácido nicotinúrico, con una vida media de eliminación plasmática de 20–45 minutos.[22]
El ácido nicotínico y la nicotinamida se convierten en el coenzima NAD,[63] que puede fosforilarse a NADP por la NAD+ quinasa. Los órganos con alta demanda energética (por ejemplo, el cerebro) o alta rotación (por ejemplo, intestino, piel) son más susceptibles a la deficiencia.[64] En el hígado, la nicotinamida se almacena como NAD, se hidroliza a ácido nicotínico o nicotinamida para su distribución tisular y se reconvierte en NAD como cofactor de enzimas, según sea necesario.[23] El exceso de ácido nicotínico se metila a N1-metilnicotinamida (NMN) y se excreta en la orina como NMN o sus metabolitos oxidados, N1-metil-2-piridona-5-carboxamida y N1-metil-4-piridona-3-carboxamida (2PY y 4PY). Niveles urinarios bajos de estos metabolitos indican deficiencia de niacina.[23]
Producción
Biosíntesis

Además de absorber la niacina de la dieta, el ácido nicotínico puede sintetizarse a partir del aminoácido esencial triptófano, un proceso de cinco pasos cuyo penúltimo compuesto es el ácido quinolínico (véase la imagen). Algunas bacterias y plantas utilizan el ácido aspártico en una vía que también conduce al ácido quinolínico.[65] Para los seres humanos, la eficacia de la conversión se estima en 60 mg de triptófano para producir 1 mg de niacina. Para el proceso se necesitan riboflavina, vitamina B6 y hierro.[23] La pelagra es consecuencia de una dieta en la que predomina el maíz, ya que la niacina del maíz es poco biodisponible y las proteínas del maíz son bajas en triptófano en comparación con las proteínas del trigo y el arroz.[66]
Síntesis industrial
El ácido nicotínico se sintetizó por primera vez en 1867 mediante la oxidación de nicotina con cromato de potasio y ácido sulfúrico, de donde deriva su nombre.[67][19] La producción moderna implica la hidrólisis de nicotinonitrilo, producido por la oxidación de 3-picolina. La oxidación puede realizarse con aire, pero la amoxidaciónes más eficaz. En este último proceso, el nicotinonitrilo se produce por ammoxidación de 3-metilpiridina. A continuación, se utiliza la nitrilohidratasa para catalizar el nicotinonitrilo a nicotinamida, que puede venderse directamente o convertirse en ácido nicotínico.[68] Alternativamente, el 5-etil-2-metil-piridina se sintetiza a partir de amoníaco, ácido acético y paraldehído y se oxida a ácido nicotínico.[69] Se están explorando catalizadores más ecológicos, como aluminofosfatos sustituidos con manganeso con peroxiborato de acetilo, para reducir las emisiones de óxidos de nitrógeno.[70]
La producción global, principalmente para alimentación animal y fortificación de alimentos, alcanzó 31 000 toneladas de nicotinamida en 2014.[67]
Impacto climático
La producción de ácido nicotínico genera óxido nitroso, un potente gas de efecto invernadero. En 2018, una fábrica de ácido nicotínico en Visp, Suiza, contribuyó aproximadamente con el 1% de las emisiones de gases de efecto invernadero del país.[71][72] La tecnología de depuración catalítica instalada en 2021 redujo significativamente estas emisiones.[73]
Química
Este sólido incoloro y soluble en agua es un derivado de la piridina con un grupo carboxilo (COOH) en la posición 3.[23] Otra forma de la vitamina B3, la amida nicotinamida, reemplaza el grupo carboxilo por un grupo carboxamida (CONH
2).[23]
Preparaciones
El ácido nicotínico recetado está disponible como de liberación inmediata (Niacor, tabletas de 500 mg) o de liberación prolongada (Niaspan, tabletas de 500 y 1000 mg). El recubrimiento de Niaspan retrasa la liberación durante 8–12 horas, reduciendo la vasodilatación y el rubor, pero aumentando el riesgo de hepatotoxicidad en comparación con las formas de liberación inmediata.[74][75]
Los preparados de ácido nicotínico de venta con receta en combinación con estatinas (descatalogados) se describen más arriba. En Europa se había aprobado el uso de una combinación de niacina y laropiprant, comercializada con el nombre de Tredaptive. El laropiprant es un fármaco fijador de la prostaglandina D2 que ha demostrado reducir los efectos secundarios de vasodilatación y sofocos inducidos por la niacina.[31][76][77] Un ensayo clínico no demostró eficacia adicional del Tredaptive para reducir el colesterol cuando se utilizaba junto con otras estatinas, pero sí un aumento de otros efectos secundarios.[78] El estudio dio lugar a la retirada del Tredaptive del mercado internacional.[79][80]
Historia
La niacina, como compuesto químico, fue descrita por primera vez por el químico Hugo Weidel en 1873 en sus estudios sobre la nicotina,[81] pero esto se produjo muchos años antes de que existiera el concepto de componentes alimentarios esenciales para la vida distintos de las proteínas, las grasas y los hidratos de carbono. Al principio, la nomenclatura de las vitaminas era alfabética, y Elmer McCollum las denominaba liposolubles A e hidrosolubles B.[82] Con el tiempo, se aislaron y numeraron ocho vitaminas B hidrosolubles químicamente distintas, y la niacina se denominó vitamina B3.[82]
El maíz se convirtió en un alimento básico en el sureste de Estados Unidos y en algunas partes de Europa. En 1735, Gaspar Casal describió en España una enfermedad caracterizada por la dermatitis de la piel expuesta al sol. Atribuyó la causa a una dieta inadecuada.[83] En el norte de Italia recibió el nombre de «pelagra», de la lengua lombarda (agra = parecido al acebo o al suero; pell = piel).[84][85] Con el tiempo, la enfermedad se relacionó más estrechamente con el maíz.[86] En Estados Unidos, el Cirujano General encargó a Joseph Goldberger el estudio de la pelagra. Sus estudios confirmaron que la dieta a base de maíz era la culpable, pero no identificó la causa principal.[87][88]
El bioquímico Conrad Elvehjem extrajo el ácido nicotínico del hígado en 1937. Más tarde identificó el principio activo y se refirió a él como «factor preventivo de la pelagra» y «factor antilengua negra».[89] También se le denominó «vitamina PP», «vitamina P-P» y «factor PP», todos ellos derivados del término «factor preventivo de la pelagra».[90] A finales de la década de 1930, los estudios de Tom Douglas Spies, Marion Blankenhorn y Clark Cooper confirmaron que el ácido nicotínico curaba la pelagra en humanos.[91] Gracias a ello, la prevalencia de la enfermedad se redujo considerablemente.[92] El ácido nicotínico se sintetizó inicialmente oxidando la nicotina con cromato de potasio y ácido sulfúrico.[19] Por ello, en 1942, cuando comenzó el enriquecimiento de la harina con ácido nicotínico, un titular de la prensa popular decía «Tabaco en su pan». En respuesta, el Consejo de Alimentación y Nutrición de la Asociación Médica Estadounidense aprobó los nuevos nombres de niacina y amida de niacina del Consejo de Alimentación y Nutrición para su uso principalmente por personas no científicas. Se consideró apropiado elegir un nombre que disociara el ácido nicotínico de la nicotina, para evitar la percepción de que las vitaminas o los alimentos ricos en niacina contienen nicotina, o que los cigarrillos contienen vitaminas. El nombre resultante, niacina, derivaba de «nicotinic acid» + «vitamin».[93][19]
Carpenter descubrió en 1951, que la niacina en el maíz no está biológicamente disponible, y sólo puede ser liberada en agua de cal muy alcalina de pH 11. Esto explica por qué una cultura latinoamericana que utilizaba harina de maíz tratada con álcali para hacer tortilla no corría riesgo de deficiencia de niacina.[94] La explicación moderna es que el tratamiento con álcali aumenta la biodisponibilidad del triptófano, no directamente para cualquier forma de la vitamina.[95]: §5.2
En 1955, Altschul y sus colegas describieron que grandes cantidades de ácido nicotínico tenían propiedades hipolipemiantes.[96] Como tal, la niacina es el fármaco hipolipemiante más antiguo que se conoce.[97] La lovastatina, el primer fármaco «estatina», se comercializó por primera vez en 1987.[98]
Presencia extraterrestre
El ácido nicotínico ha sido detectado en condritas carbonáceas y muestras de los asteroides 162173 Ryugu y 101955 Bennu. La tabla a continuación resume las concentraciones de los vitámeros de la vitamina B3 en estas fuentes.
| Asteroide | Ácido nicotínico | Nicotinamida |
|---|---|---|
| 101955 Bennu[18] | 0.43 nmol/g | No reportado |
| 162173 Ryugu | 0.40 nmol/g,[18] 99ppb[17] | No reportado[17] |
| Meteorito | Ácido nicotínico | Nicotinamide |
| Orgueil[17] | 715ppb | 214ppb |
| Murray[16] | 626ppb | 65ppb |
| Murchison | 2.4 nmol/g,[18] 190ppb[16] | 16ppb[16] |
| Tagish Lake[16] | 108ppb | 5ppb |
Compuestos químicos
Los ácidos nicotínicos y su nicotinamida amida son las formas comunes de la vitamina-B niacina. Fuera del campo de la nutrición, el término "nicotínico" es a veces utilizado para referir a una familia más amplia de compuestos, incluyendo:
- Arecolina
- nicotinamida
- Nicorandil
- Niketamida
- Nimodipina
- Trigonelina
| Niacina | Nimodipina | Arecolina | Trigonelina |
|---|---|---|---|
 |
 |
 |
 |
Véase también
- Ácidos isonicotínicos
Notas
- ↑ Denominación común internacional.
- ↑ Denominación común en Estados Unidos (niacin).
Referencias
- ↑ «Chapter P-6. Applications to Specific Classes of Compounds». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: Royal Society of Chemistry. 2014. pp. 648-1047. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-00648.
- ↑ Martindale: the complete drug reference. Martindale (en inglés) (37 edición). London: Pharmaceutical press. 2011. p. 2117. ISBN 978-0-85369-933-0. OCLC 1256529676. Parámetro desconocido
|Apellidos 1=ignorado (ayuda) - ↑ Número CAS
- ↑ a b c d e f g h i j «Niacin Fact Sheet for Health Professionals» [Hoja informativa sobre la niacina para profesionales de la salud] (en inglés). Office of Dietary Supplements, US National Institutes of Health. 18 de noviembre de 2022. Consultado el 12 de diciembre de 2024.
- ↑ a b c d e f «Niacin» [Niacina] (en inglés). Centro de Información de Micronutrientes, Instituto Linus Pauling, Universidad Estatal de Oregón. 8 de octubre de 2018. Archivado desde el original el 12 de septiembre de 2019. Consultado el 16 de septiembre de 2019.
- ↑ a b Instituto de Medicina (1998). «Niacin» [Niacina]. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline [Ingesta de referencia dietética para tiamina, riboflavina, niacina, vitamina B6, folato, vitamina B12, ácido pantoténico, biotina y colina] (en inglés). Washington, DC: The National Academies Press. pp. 123-149. ISBN 978-0-309-06554-2. Archivado desde el original el 1 de septiembre de 2018. Consultado el 29 de agosto de 2018.
- ↑ a b c «Niacin» [Niacina]. Drugs.com (en inglés). 16 de marzo de 2019. Archivado desde el original el 9 de junio de 2020. Consultado el 27 de abril de 2020.
- ↑ a b Keene, D.; Price, C.; Shun-Shin, M. J.; Francis, D. P. (Julio de 2014). «Effect on cardiovascular risk of high density lipoprotein targeted drug treatments niacin, fibrates, and CETP inhibitors: meta-analysis of randomised controlled trials including 117,411 patients» [Efecto sobre el riesgo cardiovascular de tratamientos farmacológicos dirigidos a la lipoproteína de alta densidad: niacina, fibratos e inhibidores de CETP: metaanálisis de ensayos controlados aleatorios con 117,411 pacientes]. BMJ (en inglés) 349: g4379. PMC 4103514. PMID 25038074. doi:10.1136/bmj.g4379.
- ↑ Bruckert, Eric; Labreuche, Julien; Amarenco, Pierre (1 de junio de 2010). «Meta-analysis of the effect of nicotinic acid alone or in combination on cardiovascular events and atherosclerosis». Atherosclerosis (en inglés) 210 (2): 353-361. ISSN 0021-9150. PMID 20079494. doi:10.1016/j.atherosclerosis.2009.12.023. Consultado el 28 de abril de 2025.
- ↑ a b Schandelmaier, S.; Briel, M.; Saccilotto, R.; Olu, K. K.; Arpagaus, A.; Hemkens, L. G.; A. J. (Junio de 2017). «Niacin for primary and secondary prevention of cardiovascular events» [Niacina para la prevención primaria y secundaria de eventos cardiovasculares]. The Cochrane Database of Systematic Reviews (en inglés) 2017 (6): CD009744. PMC 6481694. PMID 28616955. doi:10.1002/14651858.CD009744.pub2.
- ↑ a b c «Niacin». LiverTox: Información clínica y de investigación sobre lesiones hepáticas inducidas por medicamentos [Niacina] (en inglés). Bethesda, MD: Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales. Febrero de 2014. PMID 31643504.
- ↑ a b c d Ong KL, Barter PJ, Waters DD (Abril de 2014). «Cardiovascular drugs that increase the risk of new-onset diabetes» [Fármacos cardiovasculares que aumentan el riesgo de diabetes de inicio reciente]. American Heart Journal (en inglés) 167 (4): 421-428. PMID 24655688. doi:10.1016/j.ahj.2013.12.025.
- ↑ a b c Goldie C, Taylor AJ, Nguyen P, McCoy C, Zhao XQ, Preiss D (Febrero de 2016). «Niacin therapy and the risk of new-onset diabetes: a meta-analysis of randomised controlled trials» [Terapia con niacina y el riesgo de diabetes de inicio reciente: metaanálisis de ensayos controlados aleatorios]. Heart (en inglés) 102 (3): 198-203. PMC 4752613. PMID 26370223. doi:10.1136/heartjnl-2015-308055.
- ↑ a b «Niacin - Drug Usage Statistics» [Niacina - Estadísticas de uso de medicamentos]. ClinCalc (en inglés). Archivado desde el original el 8 de julio de 2020. Consultado el 7 de octubre de 2022.
- ↑ Kennedy DO (Enero de 2016). «B Vitamins and the Brain: Mechanisms, Dose and Efficacy—A Review» [Vitaminas B y el cerebro: mecanismos, dosis y eficacia—Una revisión]. Nutrients (en inglés) 8 (2): 68. PMC 4772032. PMID 26828517. doi:10.3390/nu8020068.
- ↑ a b c d e Oba Y, Takano Y, Furukawa Y, Koga T, Glavin DP, Dworkin JP, Naraoka H (Abril de 2022). «Identifying the wide diversity of extraterrestrial purine and pyrimidine nucleobases in carbonaceous meteorites» [Identificación de una amplia diversidad de nucleobases de purina y pirimidina extraterrestres en meteoritos carbonáceos]. Nature Communications (en inglés) 13 (1): 2008. PMC 9042847. PMID 35473908. doi:10.1038/s41467-022-29612-x.
- ↑ a b c d Oba Y, Koga T, Takano Y, Ogawa NO, Ohkouchi N, Sasaki K, Sato H, Glavin DP, Dworkin JP, Naraoka H, Tachibana S, Yurimoto H, Nakamura T, Noguchi T, Okazaki R (Marzo de 2023). «Uracil in the carbonaceous asteroid (162173) Ryugu» [Uracilo en el asteroide carbonáceo (162173) Ryugu]. Nature Communications (en inglés) 14 (1): 1292. PMC 10030641. PMID 36944653. doi:10.1038/s41467-023-36904-3.
- ↑ a b c d Glavin DP, Dworkin JP, Alexander CM, Aponte JC, Baczynski AA, Barnes JJ, Bechtel HA, Berger EL, Burton AS, Caselli P, Chung AH, Clemett SJ, Cody GD, Dominguez G, Elsila JE, Farnsworth KK, Foustoukos DI, Freeman KH, Furukawa Y, Gainsforth Z, Graham HV, Grassi T, Giuliano BM, Hamilton VE, Haenecour P, Heck PR, Hofmann AE, House CH, Huang Y, Kaplan HH, Keller LP, Kim B, Koga T, Liss M, McLain HL, Marcus MA, Matney M, McCoy TJ, McIntosh OM, Mojarro A, Naraoka H, Nguyen AN, Nuevo M, Nuth JA, Oba Y, Parker ET, Peretyazhko TS, Sandford SA, Santos E, Schmitt-Kopplin P, Seguin F, Simkus DN, Shahid A, Takano Y, Thomas-Keprta KL, Tripathi H, Weiss G, Zheng Y, Lunning NG, Righter K, Connolly HC, Lauretta DS (2025). «Abundant ammonia and nitrogen-rich soluble organic matter in samples from asteroid (101955) Bennu» [Amoníaco abundante y materia orgánica soluble rica en nitrógeno en muestras del asteroide (101955) Bennu]. Nature Astronomy (en inglés) 9 (2): 199-210. PMC 11842271. PMID 39990238. doi:10.1038/s41550-024-02472-9.
- ↑ a b c d «Niacin and Nicotinic Acid» [Niacina y ácido nicotínico]. Journal of the American Medical Association (en inglés) 118 (10): 823. 7 de marzo de 1942. doi:10.1001/jama.1942.02830100053014.
- ↑ a b c d e f g h «Niaspan Patient Package and Product Information (PPPI)» [Información del paquete y producto de Niaspan (PPPI)] (en inglés). Diciembre de 2018. Archivado desde el original el 9 de octubre de 2022. Consultado el 9 de mayo de 2020.
- ↑ «Substances related to nicotinic acid - referral | European Medicines Agency (EMA)». www.ema.europa.eu (en inglés). 13 de marzo de 2014. Consultado el 28 de abril de 2025.
- ↑ a b c d e f «NIACOR-niacin tablet» [NIACOR-tableta de niacina]. DAILYMED, Biblioteca Nacional de Medicina de EE.UU. (en inglés). Marzo de 2020. Archivado desde el original el 9 de agosto de 2020. Consultado el 9 de mayo de 2020.
- ↑ a b c d e f g h i Penberthy WT, Kirkland JB (2020). «Niacin» [Niacina]. En Marriott BP, Birt DF, Stallings VA, Yates AA, ed. Present Knowledge in Nutrition [Conocimiento actual en nutrición] (en inglés) (11ª edición). Londres, Reino Unido: Academic Press (Elsevier). pp. 209-224. ISBN 978-0-323-66162-1.
- ↑ «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies» [Resumen de valores de referencia dietéticos para la población de la UE según el Panel de Productos Dietéticos, Nutrición y Alergias de la EFSA] (en inglés). 2017. Archivado desde el original el 28 de agosto de 2017. Consultado el 31 de agosto de 2017.
- ↑ «Nutrient reference values for Australia and New Zealand» [Valores de referencia de nutrientes para Australia y Nueva Zelanda]. Consejo Nacional de Investigación Médica y Salud (en inglés). 9 de septiembre de 2005. Archivado desde el original el 21 de enero de 2017. Consultado el 19 de junio de 2018.
- ↑ Hegyi J, Schwartz RA, Hegyi V (Enero de 2004). «Pellagra: dermatitis, dementia, and diarrhea» [Pelagra: dermatitis, demencia y diarrea]. International Journal of Dermatology (en inglés) 43 (1): 1-5. PMID 14693013. S2CID 33877664. doi:10.1111/j.1365-4632.2004.01959.x.
- ↑ «Structure/Function Claims» [Declaraciones de estructura/función]. Administración de Alimentos y Medicamentos de EE.UU. (en inglés). Diciembre de 2017. Archivado desde el original el 10 de junio de 2020. Consultado el 30 de junio de 2020.
- ↑ «Cholesterol Medications» [Medicamentos para el colesterol]. Asociación Estadounidense del Corazón (en inglés). 10 de noviembre de 2018. Archivado desde el original el 5 de abril de 2020. Consultado el 8 de mayo de 2020.
- ↑ Mani, Preethi; Rohatgi, Anand (7 de junio de 2015). «Niacin Therapy, HDL Cholesterol, and Cardiovascular Disease: Is the HDL Hypothesis Defunct?». Current Atherosclerosis Reports (en inglés) 17 (8): 43. ISSN 1534-6242. PMC 4829575. PMID 26048725. doi:10.1007/s11883-015-0521-x. Consultado el 28 de abril de 2025.
- ↑ Garg A, Sharma A, Krishnamoorthy P, Garg J, Virmani D, Sharma T, Stefanini G, Kostis JB, Mukherjee D, Sikorskaya E (Febrero de 2017). «Rol de la niacina en la práctica clínica actual: una revisión sistemática» [Role of Niacin in Current Clinical Practice: A Systematic Review]. The American Journal of Medicine (en inglés) 130 (2): 173-187. PMID 27793642. doi:10.1016/j.amjmed.2016.07.038.
- ↑ a b c Villines TC, Kim AS, Gore RS, Taylor AJ (Febrero de 2012). «Niacin: the evidence, clinical use, and future directions» [Niacina: evidencia, uso clínico y direcciones futuras]. Current Atherosclerosis Reports (en inglés) 14 (1): 49-59. PMID 22037771. S2CID 27925461. doi:10.1007/s11883-011-0212-1.
- ↑ Soga T, Kamohara M, Takasaki J, Matsumoto S, Saito T, Ohishi T, Hiyama H, Matsuo A, Matsushime H, Furuichi K (Marzo de 2003). «Molecular identification of nicotinic acid receptor» [Identificación molecular del receptor de ácido nicotínico]. Biochemical and Biophysical Research Communications (en inglés) 303 (1): 364-369. PMID 12646212. doi:10.1016/S0006-291X(03)00342-5.
- ↑ Wise A, Foord SM, Fraser NJ, Barnes AA, Elshourbagy N, Eilert M, Ignar DM, Murdock PR, Steplewski K, Green A, Brown AJ, Dowell SJ, Szekeres PG, Hassall DG, Marshall FH, Wilson S, Pike NB (Marzo de 2003). «Molecular identification of high and low affinity receptors for nicotinic acid» [Identificación molecular de receptores de alta y baja afinidad para el ácido nicotínico]. The Journal of Biological Chemistry (en inglés) 278 (11): 9869-9874. PMID 12522134. doi:10.1074/jbc.M210695200.
- ↑ Gille A, Bodor ET, Ahmed K, Offermanns S (2008). «Nicotinic acid: pharmacological effects and mechanisms of action» [Ácido nicotínico: efectos farmacológicos y mecanismos de acción]. Annual Review of Pharmacology and Toxicology (en inglés) 48: 79-106. PMID 17705685. doi:10.1146/annurev.pharmtox.48.113006.094746.
- ↑ Wanders D, Judd RL (Agosto de 2011). «Future of GPR109A agonists in the treatment of dyslipidaemia» [Futuro de los agonistas de GPR109A en el tratamiento de la dislipidemia]. Diabetes, Obesity & Metabolism (en inglés) 13 (8): 685-691. PMID 21418500. S2CID 205536280. doi:10.1111/j.1463-1326.2011.01400.x.
- ↑ a b Costet P (Junio de 2010). «Molecular pathways and agents for lowering LDL-cholesterol in addition to statins» [Vías moleculares y agentes para reducir el colesterol LDL además de las estatinas]. Pharmacology & Therapeutics (en inglés) 126 (3): 263-278. PMID 20227438. doi:10.1016/j.pharmthera.2010.02.006.
- ↑ Hernandez C, Molusky M, Li Y, Li S, Lin JD (Octubre de 2010). «Regulation of hepatic ApoC3 expression by PGC-1β mediates hypolipidemic effect of nicotinic acid» [Regulación de la expresión hepática de ApoC3 por PGC-1β media el efecto hipolipemiante del ácido nicotínico]. Cell Metabolism (en inglés) 12 (4): 411-419. PMC 2950832. PMID 20889132. doi:10.1016/j.cmet.2010.09.001.
- ↑ Malik S, Kashyap ML (Noviembre de 2003). «Niacin, lipids, and heart disease» [Niacina, lípidos y enfermedades cardíacas]. Current Cardiology Reports (en inglés) 5 (6): 470-476. PMID 14558989. S2CID 27918392. doi:10.1007/s11886-003-0109-x.
- ↑ Creider JC, Hegele RA, Joy TR (Septiembre de 2012). «Niacin: another look at an underutilized lipid-lowering medication» [Niacina: otra mirada a un medicamento hipolipemiante subutilizado]. Nature Reviews Endocrinology (en inglés) 8 (9): 517-528. PMID 22349076. S2CID 22526314. doi:10.1038/nrendo.2012.22.
- ↑ Rubic T, Trottmann M, Lorenz RL (Febrero de 2004). «Stimulation of CD36 and the key effector of reverse cholesterol transport ATP-binding cassette A1 in monocytoid cells by niacin» [Estimulación de CD36 y el efector clave del transporte inverso de colesterol ATP-binding cassette A1 en células monocitoides por niacina]. Biochemical Pharmacology (en inglés) 67 (3): 411-419. PMID 15037193. doi:10.1016/j.bcp.2003.09.014.
- ↑ «Drug Approval Package: Advicor (Niacin Extended-Release & Lovastatin) NDA #21-249» [Paquete de aprobación de medicamentos: Advicor (Niacina de liberación prolongada y lovastatina) NDA #21-249]. Administración de Alimentos y Medicamentos de EE.UU. (en inglés). 13 de septiembre de 2002. Archivado desde el original el 4 de agosto de 2020. Consultado el 17 de mayo de 2020.
- ↑ «Drug Approval Package: Simcor (Niacin/Simvastatin) NDA #022078» [Paquete de aprobación de medicamentos: Simcor (Niacina/Simvastatina) NDA #022078]. Administración de Alimentos y Medicamentos de EE.UU. (en inglés). 31 de julio de 2008. Archivado desde el original el 14 de noviembre de 2022. Consultado el 14 de noviembre de 2022.
- ↑ «Abbott Receives FDA Approval for Simcor (Niaspan / simvastatin), a Novel Combination Medicine for Comprehensive Cholesterol Management» [Abbott recibe aprobación de la FDA para Simcor (Niaspan/simvastatina), un medicamento combinado novedoso para el manejo integral del colesterol]. Drugs.com (en inglés). Archivado desde el original el 5 de agosto de 2020. Consultado el 15 de marzo de 2008.
- ↑ Toth PP, Murthy AM, Sidhu MS, Boden WE (2015). «Is HPS2-THRIVE the death knell for niacin?» [¿Es HPS2-THRIVE el fin de la niacina?]. Journal of Clinical Lipidology (en inglés) 9 (3): 343-350. PMID 26073392. doi:10.1016/j.jacl.2015.01.008.
- ↑ «AbbVie Inc.; Withdrawal of Approval of New Drug Applications for Advicor and Simcor» [AbbVie Inc.; Retiro de la aprobación de solicitudes de nuevos medicamentos para Advicor y Simcor]. Registro Federal de EE.UU. (en inglés). 18 de abril de 2016. Archivado desde el original el 5 de agosto de 2020. Consultado el 17 de mayo de 2020.
- ↑ a b c d e «Niaspan- niacin tablet, film coated, extended release» [Niaspan-tableta de niacina, recubierta de película, liberación prolongada]. DailyMed (en inglés). 20 de agosto de 2013. Archivado desde el original el 14 de noviembre de 2022. Consultado el 14 de noviembre de 2022.
- ↑ a b Papaliodis D, Boucher W, Kempuraj D, Michaelian M, Wolfberg A, House M, Theoharides TC (Diciembre de 2008). «Niacin-induced "flush" involves release of prostaglandin D2 from mast cells and serotonin from platelets: evidence from human cells in vitro and an animal model» [El "rubor" inducido por la niacina involucra la liberación de prostaglandina D2 de mastocitos y serotonina de plaquetas: evidencia de células humanas in vitro y un modelo animal]. The Journal of Pharmacology and Experimental Therapeutics (en inglés) 327 (3): 665-672. PMID 18784348. S2CID 5609632. doi:10.1124/jpet.108.141333.
- ↑ Benyó Z, Gille A, Kero J, Csiky M, Suchánková MC, Nüsing RM, Moers A, Pfeffer K, Offermanns S (Diciembre de 2005). «GPR109A (PUMA-G/HM74A) mediates nicotinic acid-induced flushing» [GPR109A (PUMA-G/HM74A) media el rubor inducido por ácido nicotínico]. The Journal of Clinical Investigation (en inglés) 115 (12): 3634-3640. PMC 1297235. PMID 16322797. doi:10.1172/JCI23626.
- ↑ Benyó Z, Gille A, Bennett CL, Clausen BE, Offermanns S (Diciembre de 2006). «Nicotinic acid-induced flushing is mediated by activation of epidermal langerhans cells» [El rubor inducido por ácido nicotínico está mediado por la activación de células de Langerhans epidérmicas]. Molecular Pharmacology (en inglés) 70 (6): 1844-1849. PMID 17008386. S2CID 30199951. doi:10.1124/mol.106.030833.
- ↑ Maciejewski-Lenoir D, Richman JG, Hakak Y, Gaidarov I, Behan DP, Connolly DT (Diciembre de 2006). «Langerhans cells release prostaglandin D2 in response to nicotinic acid» [Las células de Langerhans liberan prostaglandina D2 en respuesta al ácido nicotínico]. The Journal of Investigative Dermatology (en inglés) 126 (12): 2637-2646. PMID 17008871. doi:10.1038/sj.jid.5700586.
- ↑ Kamanna VS, Kashyap ML (Abril de 2008). «Mechanism of action of niacin» [Mecanismo de acción de la niacina]. The American Journal of Cardiology (en inglés) 101 (8A): 20B-26B. PMID 18375237. doi:10.1016/j.amjcard.2008.02.029.
- ↑ Katzung, Bertram G., ed. (2007). Basic & clinical pharmacology. A Lange medical book (en inglés) (10. ed edición). McGraw-Hill. ISBN 978-0-07-145153-6.
- ↑ Barter, Philip (1 de octubre de 2006). «Options for therapeutic intervention: how effective are the different agents?». European Heart Journal Supplements (en inglés) 8 (suppl_F): F47-F53. ISSN 1520-765X. doi:10.1093/eurheartj/sul041. Consultado el 28 de abril de 2025.
- ↑ «Niacin: The facts on flushing» [Niacina: Información sobre el rubor]. www.dpic.org (en inglés). Consultado el 19 de marzo de 2025.
- ↑ a b Dickey W, McAleer JJ, Callender ME (Abril de 1991). «Prueba de provocación con ácido nicotínico e hiperbilirrubinemia no conjugada» [The Nicotinic Acid Provocation Test and Unconjugated Hyperbilirubinaemia]. The Ulster Medical Journal (en inglés) 60 (1): 49-52. PMC 2448612. PMID 1853497.
- ↑ a b Röllinghoff W, Paumgartner G, Preisig R (Agosto de 1981). «Nicotinic Acid Test in the Diagnosis of Gilbert's Syndrome: Correlation With Bilirubin Clearance» [Prueba de ácido nicotínico en el diagnóstico del síndrome de Gilbert: correlación con la eliminación de bilirrubina]. Gut (en inglés) 22 (8): 663-668. PMC 1420060. PMID 7286783. doi:10.1136/gut.22.8.663.
- ↑ Domanico D, Verboschi F, Altimari S, Zompatori L, Vingolo EM (2015). «Ocular Effects of Niacin: A Review of the Literature» [Efectos oculares de la niacina: una revisión de la literatura]. Medical Hypothesis, Discovery & Innovation in Ophthalmology (en inglés) 4 (2): 64-71. PMC 4458328. PMID 26060832.
- ↑ Zeman M, Vecka M, Perlík F, Hromádka R, Staňková B, Tvrzická E, Žák A (Julio de 2015). «Niacin in the Treatment of Hyperlipidemias in Light of New Clinical Trials: Has Niacin Lost its Place?» [Niacina en el tratamiento de hiperlipidemias a la luz de nuevos ensayos clínicos: ¿ha perdido su lugar la niacina?]. Medical Science Monitor (en inglés) 21: 2156-2162. PMC 4523006. PMID 26210594. doi:10.12659/MSM.893619.
- ↑ Wu BJ, Yan L, Charlton F, Witting P, Barter PJ, Rye KA (Mayo de 2010). «Evidence that niacin inhibits acute vascular inflammation and improves endothelial dysfunction independent of changes in plasma lipids» [Evidencia de que la niacina inhibe la inflamación vascular aguda y mejora la disfunción endotelial independientemente de los cambios en los lípidos plasmáticos]. Arteriosclerosis, Thrombosis, and Vascular Biology (en inglés) 30 (5): 968-975. PMID 20167660. doi:10.1161/ATVBAHA.109.201129.
- ↑ Gaudineau C, Auclair K (Mayo de 2004). «Inhibition of human P450 enzymes by nicotinic acid and nicotinamide» [Inhibición de enzimas P450 humanas por ácido nicotínico y nicotinamida]. Biochemical and Biophysical Research Communications (en inglés) 317 (3): 950-956. PMID 15081432. doi:10.1016/j.bbrc.2004.03.137.
- ↑ Orkin SH, Nathan DG (Enero de 2009). Nathan and Oski's Hematology of Infancy and Childhood [Hematología de la infancia y la niñez de Nathan y Oski] (en inglés). Elsevier Health Sciences. pp. 118-119. ISBN 9781416034308.
- ↑ Said HM (Agosto de 2011). «Absorción intestinal de vitaminas hidrosolubles en salud y enfermedad» [Intestinal absorption of water-soluble vitamins in health and disease]. The Biochemical Journal (en inglés) 437 (3): 357-372. PMC 4049159. PMID 21749321. doi:10.1042/BJ20110326.
- ↑ Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (2000). Lehninger principles of biochemistry (en inglés) (3rd ed edición). Worth Publishers. ISBN 978-1-57259-153-0.
- ↑ Ishii N, Nishihara Y (Marzo de 1981). «"Pellagra among chronic alcoholics: clinical and pathological study of 20 necropsy cases» [Pelagra entre alcohólicos crónicos: estudio clínico y patológico de 20 casos de necropsia]. Journal of Neurology, Neurosurgery, and Psychiatry (en inglés) 44 (3): 209-215. PMC 490893. PMID 7229643. doi:10.1136/jnnp.44.3.209.
- ↑ Foster JW, Moat AG (Marzo de 1980). «Nicotinamide adenine dinucleotide biosynthesis and pyridine nucleotide cycle metabolism in microbial systems» [Biosíntesis de dinucleótido de nicotinamida y adenina y metabolismo del ciclo de nucleótidos de piridina en sistemas microbianos]. Microbiology and Molecular Biology Reviews (en inglés) 44 (1): 83-105. PMC 373235. PMID 6997723. doi:10.1128/MMBR.44.1.83-105.1980.
- ↑ Carpenter KJ (1983). «La relación de la pelagra con el maíz y la baja disponibilidad de niacina en cereales». The Relationship of Pellagra to Corn and the Low Availability of Niacin in Cereals [Adecuación nutricional, disponibilidad de nutrientes y necesidades]. Experientia Supplementum (en inglés) 44. pp. 197-222. ISBN 978-3-0348-6542-5. PMID 6357846. doi:10.1007/978-3-0348-6540-1_12.
- ↑ a b Blum R (2015). «Vitamins, 11. Niacin (Nicotinic Acid, Nicotinamide)». Ullmann's Encyclopedia of Industrial Chemistry (6ª edición). Weinheim: Wiley-VCH. pp. 1-9. ISBN 978-3-527-30385-4. doi:10.1002/14356007.o27_o14.pub2.
- ↑ Abe N, Ichimura H, Kataoka T, Morishita S, Shimizu S, Shoji T, Watanabe N (2007). «Pyridine and Pyridine Derivatives». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3527306732. doi:10.1002/14356007.a22_399.
- ↑ Eschenmooser W (Junio de 1997). «100 años de progreso con LONZA» [100 Years of Progress with LONZA]. CHIMIA (en inglés) 51 (6): 259-269. S2CID 100485418. doi:10.2533/chimia.1997.259.
- ↑ Sarah Everts (2008). «Clean Catalysis: Environmentally friendly synthesis of niacin generates less inorganic waste» [Catalización limpia: Síntesis ecológica de niacina genera menos residuos inorgánicos]. Chemical & Engineering News (en inglés). ISSN 0009-2347.
- ↑ Lenz C (2021). «The climate disgrace of Visp» [La vergüenza climática de Visp]. European Press Prize (en inglés). Archivado desde el original el 8 de septiembre de 2023. Consultado el 8 de septiembre de 2023.
- ↑ Laudert D, Hohmann HP (2011). Application of Enzymes and Microbes for the Industrial Production of Vitamins and Vitamin-Like Compounds [Aplicación de enzimas y microbios para la producción industrial de vitaminas y compuestos similares a vitaminas] (en inglés). Elsevier. p. 620. ISBN 978-0-444-64047-5. doi:10.1016/b978-0-444-64046-8.00188-9. «Lonza AG de Suiza produce ácido nicotínico en su planta de producción suiza de Visp, mientras que el centro de fabricación de la amida se encuentra en China, en la provincia de Guangdong.»
- ↑ Davidson EA, Winiwarter W (Julio de 2023). «Urgent abatement of industrial sources of nitrous oxide» [Reducción urgente de fuentes industriales de óxido nitroso]. Nature Climate Change (en inglés) 13 (7): 599-601. Bibcode:2023NatCC..13..599D. doi:10.1038/s41558-023-01723-3.
- ↑ Bassan M (2012). «A case for immediate-release niacin» [Un caso para la niacina de liberación inmediata]. Heart & Lung (en inglés) 41 (1): 95-98. PMID 21414665. doi:10.1016/j.hrtlng.2010.07.019.
- ↑ Reiche I, Westphal S, Martens-Lobenhoffer J, Tröger U, Luley C, Bode-Böger SM (Enero de 2011). «Farmacocinética y recomendaciones de dosis de Niaspan en pacientes con enfermedad renal crónica y diálisis» [Pharmacokinetics and dose recommendations of Niaspan in chronic kidney disease and dialysis patients]. Nephrology, Dialysis, Transplantation (en inglés) 26 (1): 276-282. PMID 20562093. doi:10.1093/ndt/gfq344.
- ↑ Lai E, De Lepeleire I, Crumley TM, Liu F, Wenning LA, Michiels N, Vets E, O'Neill G, Wagner JA, Gottesdiener K (Junio de 2007). «Suppression of niacin-induced vasodilation with an antagonist to prostaglandin D2 receptor subtype 1» [Supresión de la vasodilatación inducida por niacina con un antagonista del subtipo 1 del receptor de prostaglandina D2]. Clinical Pharmacology and Therapeutics (en inglés) 81 (6): 849-857. PMID 17392721. S2CID 2126240. doi:10.1038/sj.clpt.6100180.
- ↑ Paolini JF, Bays HE, Ballantyne CM, Davidson M, Pasternak R, Maccubbin D, Norquist JM, Lai E, Waters MG, Kuznetsova O, Sisk CM, Mitchel YB (Noviembre de 2008). «Extended-release niacin/laropiprant: reducing niacin-induced flushing to better realize the benefit of niacin in improving cardiovascular risk factors» [Niacina de liberación prolongada/laropiprant: reducción del rubor inducido por niacina para aprovechar mejor el beneficio de la niacina en la mejora de los factores de riesgo cardiovascular]. Cardiology Clinics (en inglés) 26 (4): 547-560. PMID 19031552. doi:10.1016/j.ccl.2008.06.007.
- ↑ Landray MJ, Haynes R, Hopewell JC, Parish S, Aung T, Tomson J, Wallendszus K, Craig M, Jiang L, Collins R, Armitage J (Julio de 2014). «Effects of extended-release niacin with laropiprant in high-risk patients» [Efectos de la niacina de liberación prolongada con laropiprant en pacientes de alto riesgo]. New England Journal of Medicine (en inglés) 371 (3): 203-212. PMID 25014686. S2CID 23548060. doi:10.1056/NEJMoa1300955.
- ↑ Nainggolan L (11 de enero de 2013). «Niacin/Laropiprant Products to Be Suspended Worldwide» [Productos de niacina/laropiprant serán suspendidos mundialmente]. Medscape (en inglés). Archivado desde el original el 26 de abril de 2015. Consultado el 20 de febrero de 2017.
- ↑ «Merck begins overseas recall of HDL cholesterol drug» [Merck inicia la retirada mundial del medicamento para el colesterol HDL]. Reuters (en inglés). 11 de enero de 2013. Archivado desde el original el 21 de abril de 2023. Consultado el 6 de julio de 2021.
- ↑ Weidel H (1873). «Zur Kenntniss des Nicotins» [Sobre el conocimiento de la nicotina]. Justus Liebigs Annalen der Chemie und Pharmacie (en inglés) 165 (2): 330-349. doi:10.1002/jlac.18731650212. Archivado desde el original el 4 de agosto de 2020. Consultado el 3 de julio de 2019.
- ↑ a b Combs GF (2007). The Vitamins: Fundamental Aspects in Nutrition and Health [Las vitaminas: aspectos fundamentales en nutrición y salud] (en inglés) (3ª edición). Boston, MA: Elsevier. pp. 7-33. ISBN 978-0-080-56130-1. Archivado desde el original el 13 de enero de 2023. Consultado el 30 de junio de 2020.
- ↑ Casal G (1945). «La historia natural y médica del principado de Asturias». En Major RH, ed. The natural and medical history of the principality of the Asturias [Descripciones clásicas de enfermedades] (en inglés) (3ª edición). Springfield: Charles C Thomas. pp. 607-612.
- ↑ F. Cherubini, Vocabolario Milanese-Italiano, Imp. Regia Stamperia, 1840-43, vol. I, III.
- ↑ «Definición de pelagra». MedicineNet.com (en inglés). Archivado desde el original el 30 de septiembre de 2007. Consultado el 18 de junio de 2007.
- ↑ Cesare Lombroso, Studi clinici ed esperimentali sulla natura, causa e terapia delle pellagra (Bolonia: Fava e Garagnani, 1869).
- ↑ Evans BK, Feinstein AR (Septiembre de 1994). «Joseph Goldberger: an unsung hero of American clinical epidemiology» [Joseph Goldberger: un héroe olvidado de la epidemiología clínica estadounidense]. Annals of Internal Medicine (en inglés) 121 (5): 372-375. PMID 8042827. S2CID 13226008. doi:10.7326/0003-4819-121-5-199409010-00010.
- ↑ Kraut A. «El Dr. Joseph Goldberger y la guerra contra la pelagra» [Dr. Joseph Goldberger and the War on Pellagra | Ashes on the Potomac]. history.nih.gov (en inglés). Archivado desde el original el 9 de mayo de 2020. Consultado el 20 de febrero de 2017.
- ↑ Elvehjem CA, Madden RJ, Strongandd FM, Woolley DW (1938). «The isolation and identification of the anti-blacktongue factor J». J. Biol. Chem. (en inglés) 123 (1): 137-49. doi:10.1016/S0021-9258(18)74164-1. Archivado desde el original el 9 de octubre de 2022.
- ↑ World Health Organization (2000), Pellagra And Its Prevention And Control In Major Emergencies (en inglés), World Health Organization (WHO), WHO/NHD/00.10.
- ↑ SPIES, TOM D.; COOPER, CLARK; BLANKENHORN, M. A. (26 de febrero de 1938). «THE USE OF NICOTINIC ACID IN THE TREATMENT OF PELLAGRA». Journal of the American Medical Association (en inglés) 110 (9): 622-627. ISSN 0002-9955. doi:10.1001/jama.1938.02790090004002. Consultado el 1 de mayo de 2025.
- ↑ Sachs RH (2003). White Rose History (en inglés). p. Appendix D, p. 2. ISBN 978-0-9710541-9-6. Archivado desde el original el 21 de abril de 2023.
- ↑ Consejo de Alimentos y Nutrición (7 de marzo de 1942). «Niacina y niacinamida». Journal of the American Medical Association 118 (10): 819. doi:10.1001/jama.1942.02830100049011.
- ↑ Laguna J, Carpenter KJ (Septiembre de 1951). «Raw versus processed corn in niacin-deficient diets» [Maíz crudo versus maíz procesado en dietas deficientes en niacina]. The Journal of Nutrition (en inglés) 45 (1): 21-28. PMID 14880960. doi:10.1093/jn/45.1.21.
- ↑ Maíz en la nutrición humana. Roma: Organización de las Naciones Unidas para la Alimentación y la Agricultura. 1992. ISBN 9789251030134. – Sección 5.2 "Maíz tratado con cal (parte II)", Sección 8 "Mejora de las dietas de maíz"
- ↑ Altschul R, Hoffer A, Stephen JD (Febrero de 1955). «Influence of nicotinic acid on serum cholesterol in man» [Influencia del ácido nicotínico en el colesterol sérico en el hombre]. Archives of Biochemistry and Biophysics (en inglés) 54 (2): 558-559. PMID 14350806. doi:10.1016/0003-9861(55)90070-9.
- ↑ Romani M, Hofer DC, Katsyuba E, Auwerx J (Abril de 2019). «Niacin: an old lipid drug in a new NAD+ dress» [Niacina: un antiguo fármaco lipídico en un nuevo vestido de NAD+]. Journal of Lipid Research (en inglés) 60 (4): 741-746. PMC 6446705. PMID 30782960. doi:10.1194/jlr.S092007.
- ↑ Simons J (Enero de 2003). «The $10 billion pill» [La píldora de 10 mil millones de dólares]. Fortune 147 (1): 58-62, 66, 68. PMID 12602122.
Enlaces externos
- MeSH: Nicotinic+Acids (en inglés) En los EE.UU. Biblioteca Nacional de Medicina Tema Médico Headings (MALLA)