Nerol
| Nerol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
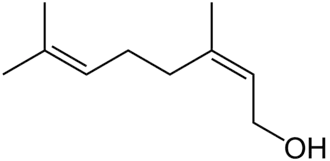
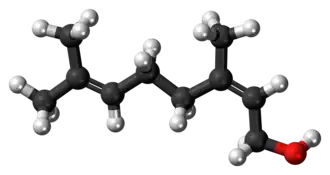
| (Z)-3,7-dimethyl-2,6-octadien-1-ol | ||
| General | ||
| Fórmula estructural |
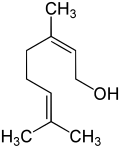 | |
| Fórmula molecular | C10H18O | |
| Identificadores | ||
| Número CAS | 106-25-2[1] | |
| ChEBI | 29452 | |
| ChEMBL | 452683 | |
| ChemSpider | 558917 | |
| PubChem | 643820 | |
| UNII | 38G5P53250 | |
| KEGG | C09871 | |
|
OC\C=C(/CC/C=C(/C)C)C
| ||
| Propiedades físicas | ||
| Densidad | 0,881 kg/m³; 0,000881 g/cm³ | |
| Masa molar | 154,25 g/mol | |
| Punto de fusión | 258 K (−15 °C) | |
| Punto de ebullición | 493 K (220 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El nerol es un alcohol monoterpenoide que se encuentra en muchos aceites esenciales, como los que se encuentran en la hierba limón y el lúpulo. Originalmente se aisló del aceite de neroli, de ahí su nombre. Este líquido incoloro se utiliza en perfumería. Al igual que el geraniol, el nerol tiene un olor a rosas, pero se considera más fresco que éste.[2] Los ésteres y derivados relacionados con el nerol se denominan nerilos, por ejemplo, el acetato de nerilo.
El nerol es isómero del geraniol, en el que el doble enlace es trans. Pierde agua fácilmente para formar dipenteno. El nerol puede sintetizarse mediante pirólisis del beta-pineno, que también produce mirceno. La hidrocloración del mirceno da lugar a una serie de cloruros isoméricos.
Referencias
- ↑ Número CAS
- ↑ Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg “Flavors and Fragrances” in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi 10.1002/14356007.a11_141.
Enlaces externos
- Esta obra contiene una traducción derivada de «Nerol» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.