Inmunocitoquímica
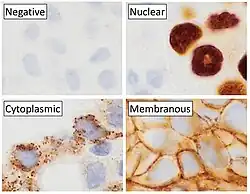


Inmunohistoquímica es una forma de inmunotinción que permite identificar selectivamente antígenos en células y tejidos, mediante anticuerpos que se unen específicamente a dichos antígenos. Albert Hewett Coons, Ernest Berliner, Norman Jones y Hugh J Creech desarrollaron la inmunofluorescencia por primera vez en 1941, lo que condujo posteriormente al desarrollo de la inmunohistoquímica.[2][3]
La inmunohistoquímica se usa ampliamente para diagnosticar células anormales, como las de tumores cáncerosos, y también en investigación básica para estudiar la distribución y localización de biomarcadores y proteínas expresadas diferencialmente en distintos tejidos.[4]
Preparación de la muestra
La inmunohistoquímica puede realizarse sobre tejido fijado y embebido en parafina, así como en tejido congelado. El proceso general incluye: fijación adecuada, recuperación de antígenos, incubación con anticuerpo primario y luego con anticuerpo secundario.[5][6]
Preparación y fijación del tejido
La fijación preserva la morfología celular. La fórmula de fijación, la proporción de fijador a tejido y el tiempo de fijación afectan el resultado. El fijador suele ser formalina al 10% en tampón neutro. Tiempo típico: 24 horas a temperatura ambiente, con proporción fijador:tejido de 1:1 a 1:20. Luego se puede embedir en parafina.[5][6]
En secciones congeladas, la fijación suele hacerse después del corte, usando acetona o formalina.[6]
Corte de secciones
Se utiliza un micrótomo. Para tejidos embebidos en parafina, grosor típico: 4 μm; para congelados: 4–6 μm.[6] El grosor influye en la visualización de estructuras y proteínas. Los tejidos de parafina deben desparafinarse en xileno o sustituto, seguido de alcohol.[7]
Recuperación de antígenos
Se realiza para exponer los epítopos que pueden estar bloqueados por la fijación, normalmente usando calor en solución tampón (microondas, autoclave, placas calefactoras o baños de agua). No siempre es necesaria en secciones congeladas, pero puede mejorar la señal si se fijaron en acetona o formalina.[6][8]
Bloqueo
Para reducir tinción de fondo se incuba con suero normal del mismo animal del anticuerpo secundario o con buffers comerciales. Otros bloqueadores incluyen leche desnatada, BSA o gelatina. Actividad enzimática endógena también puede ser bloqueada con peróxido de hidrógeno.[5][6]
Etiquetado de la muestra
Se visualiza usando anticuerpos marcados con fluorescentes, metales o enzimas.
Tipos de anticuerpos
- **Policlonales**: producidos inyectando el antígeno en animales como cobayos, conejos, ratones, ratas o cabras; reconocen múltiples epítopos.
- **Monoclonales**: producen anticuerpos contra un único epítopo mediante hibridoma (célula B + línea celular cancerosa).
Anticuerpos se clasifican como primarios (contra el antígeno) o secundarios (contra los Ig del animal del primario), y estos últimos suelen estar conjugados a reporteros como biotina o directamente al marcador.[9]
Métodos de detección
- **Directo**: anticuerpo marcado se une directamente al antígeno; rápido pero menos sensible.
- **Indirecto**: anticuerpo primario sin marcar se une al antígeno, y luego el secundario marcado se une al primario. Más sensible por amplificación de señal y permite usar menos anticuerpos secundarios estandarizados.[9]
Moléculas reporteras
- **Cromogénicas**: enzimas (fosfatasa alcalina, peroxidasa) que producen un color al actuar sobre un sustrato como DAB.
- **Fluorescentes**: fluorocromos como FITC, TRITC, Alexa Fluor; se visualizan con microscopio de fluorescencia o confocal.[10]
Contracolorantes
Se aplican para dar contraste y facilitar la identificación de la morfología del tejido. Ejemplo: Hematoxilina.[6]
Resolución de problemas
Problemas frecuentes: tinción de fondo fuerte, señal débil o artefactos. Se corrigen ajustando dilución, tiempo, temperatura, sistema de detección, o usando controles positivos y negativos.[5][11]
Marcadores diagnósticos
Ejemplos: CD3, CD20, CD10, p53, Ki-67, receptores hormonales, marcadores neuronales. Permiten localizar proteínas y analizar tejidos específicos.
Referencias
- ↑ Imagen por Mikael Häggström, MD. Terminología: Anjelica Hodgson, M.D., Carlos Parra-Herran, M.D. «p16». Pathology Outlines. Última actualización: 25 de enero de 2024
- ↑ Ortiz Hidalgo, Carlos (2022), «Immunohistochemistry in Historical Perspective: Knowing the Past to Understand the Present», en Del Valle, Luis, ed., Immunohistochemistry and Immunocytochemistry, Methods in Molecular Biology (en inglés) (New York, NY: Springer US) 2422: 17-31, ISBN 978-1-0716-1947-6, PMID 34859396, S2CID 244861186, doi:10.1007/978-1-0716-1948-3_2, consultado el 22 de febrero de 2024.
- ↑ «Immunohistochemistry: Origins, Tips, and a Look to the Future». The Scientist Magazine® (en inglés). Consultado el 22 de febrero de 2024.
- ↑ Duraiyan, Jeyapradha; Govindarajan, Rajeshwar; Kaliyappan, Karunakaran; Palanisamy, Murugesan (2012). «Applications of immunohistochemistry». Journal of Pharmacy and Bioallied Sciences (en inglés) 4 (6): S307-9. ISSN 0975-7406. PMC 3467869. PMID 23066277. doi:10.4103/0975-7406.100281.
- ↑ a b c d Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadas:1 - ↑ a b c d e f g Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadas:2 - ↑ Binch, Abbie; Snuggs, Joseph; Le Maitre, Christine L. (15 de mayo de 2020). «Immunohistochemical analysis of protein expression in formalin fixed paraffin embedded human intervertebral disc tissues». JOR Spine (en inglés) 3 (3): e1098. ISSN 2572-1143. PMC 7524243. PMID 33015573. doi:10.1002/jsp2.1098.
- ↑ Shi, Shan-Rong; Cote, Richard J.; Taylor, Clive R. (March 1997). «Antigen Retrieval Immunohistochemistry: Past, Present, and Future». Journal of Histochemistry & Cytochemistry (en inglés) 45 (3): 327-343. ISSN 0022-1554. PMID 9071315. doi:10.1177/002215549704500301.
- ↑ a b Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadas:0 - ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadas:3 - ↑ Immunohistochemistry (IHC) Staining troubleshooting