Hidruro de berilio
| Hidruro de berilio | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres |
Dihidruro de berilio | |
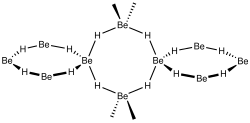
| Fórmula estructural |
| |
| Fórmula molecular | BeH2 | |
| Identificadores | ||
| Número CAS | 7787-52-2[1] | |
| ChEBI | 33787 | |
| ChemSpider | 17215712 | |
| PubChem | 139073 | |
| UNII | 5M7P3TK96I | |
| KEGG | C16460 | |
| Propiedades físicas | ||
| Densidad | 650 kg/m³; 0,65 g/cm³ | |
| Masa molar | 11,0281 g/mol | |
| Punto de fusión | 250 °C (523 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El hidruro de berilio (sistemáticamente denominado poli[berilano(2)] y dihidruro de berilio) es un compuesto inorgánico de fórmula (BeH
2)n (también escrito ([BeH2])n o BeH2). Este hidruro alcalinotérreo es un sólido incoloro e insoluble en disolventes que no lo descomponen. A diferencia de los hidruros con enlace iónico de los elementos más pesados del grupo 2, el hidruro de berilio tiene enlace covalente[2] (enlace de tres electrones en el centro).
Síntesis
A diferencia de otros metales del, el berilio no reacciona con el hidrógeno, sino que el BeH₂ se prepara a partir de compuestos preformados de berilio (II).[3] Se sintetizó por primera vez en 1951 al tratar el dimetilberilio Be(CH3)2 con hidruro de aluminio y litio LiAlH4.[4]
El BeH2 más puro se forma a partir de la pirólisis de di-terc-butilberilio, Be(C[CH3]3)2 a 210 °C.[5]
Una ruta para obtener muestras altamente puras implica la reacción de trifenilfosfina, PPh3, con borohidruro de berilio, Be(BH4)2:[2]
- Be(BH4)2 + 2 PPh3 → BeH2 + 2 Ph3PBH3
Estructura
Forma gaseosa

Las moléculas aisladas de BeH2 (a veces llamadas dihidridoberilio y escritas [BeH2] para resaltar las diferencias con el estado sólido) solo son estables como gas diluido. Cuando se condensa, el BeH2 no disuelto se autopolimeriza espontáneamente.
Se ha confirmado que el BeH2 molecular libre producido por descarga eléctrica a alta temperatura tiene geometría lineal, con una longitud de enlace Be-H de 133,376 pm. Su hibridación es sp.[6]
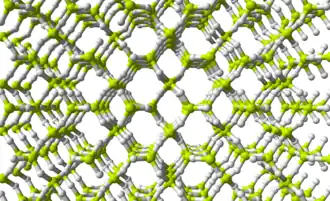
Hidruro de berilio condensado
El BeH2 suele formarse como un sólido blanco amorfo, pero se ha descrito una forma cristalina hexagonal con una densidad mayor (0,78 g/cm3),[7] preparada calentando BeH2 amorfo a presión con 0,5-2,5% de LiH como catalizador.
Una investigación más reciente encontró que el hidruro de berilio cristalino tiene una celda unitaria ortorrómbica centrada en el cuerpo, que contiene una red de tetraedros BeH4 que comparten vértices, en contraste con las cadenas infinitas, planas y con puentes de hidrógeno que anteriormente se creía que existían en el BeH2 cristalino.[8]
Los estudios de la forma amorfa también encuentran que consiste en una red de tetraedros con vértices compartidos.[9]
Propiedades químicas
Reacción con agua y ácidos
El hidruro de berilio reacciona lentamente con el agua, pero se hidroliza rápidamente con un ácido como el cloruro de hidrógeno para formar cloruro de berilio.[10]
- BeH2 + 2 H2O → Be(OH)2 + 2 H2
- BeH2 + 2 HCl → BeCl2 + 2 H2
Reacción con bases de Lewis
El grupo hidridoberilio de dos coordenadas puede aceptar un ligando donador de pares de electrones (L) en la molécula por aducción: [11]
- [BeH
2] + L → [BeH
2L]
Debido a que estas reacciones se ven favorecidas energéticamente, el hidruro de berilio tiene carácter ácido de Lewis.
La reacción con hidruro de litio (en la que el ion hidruro es la base de Lewis) forma secuencialmente LiBeH3 y Li2BeH4.[10] Este último contiene el anión tetrahidridoberilato(2-) BeH2−
4 .
El hidruro de berilio reacciona con trimetilamina, N(CH3)3 para formar un aducto dimérico con hidruros puente.[12] Sin embargo, con dimetilamina, HN(CH3)2 se forma una diamida de berilio trimérico, [Be(N(CH3)2)2]3, e hidrógeno.[3]
Referencias
- ↑ Número CAS
- ↑ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2 edición). Butterworth-Heinemann. p. 115. ISBN 978-0-08-037941-8.
- ↑ a b Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5, p. 1048
- ↑ Glenn D. Barbaras; Clyde Dillard; A. E. Finholt; Thomas Wartik; K. E. Wilzbach; H. I. Schlesinger (1951). «The Preparation of the Hydrides of Zinc, Cadmium, Beryllium, Magnesium and Lithium by the Use of Lithium Aluminum Hydride». Journal of the American Chemical Society 73 (10): 4585-4590. doi:10.1021/ja01154a025.
- ↑ G. E. Coates; F. Glockling (1954). «Di-tert.-butylberyllium and beryllium hydride». Journal of the Chemical Society: 2526-2529. doi:10.1039/JR9540002526.
- ↑ Peter F. Bernath; Alireza Shayesteh; Keith Tereszchuk; Reginald Colin (2002). «The Vibration-Rotation Emission Spectrum of Free BeH2». Science 297 (5585): 1323-1324. Bibcode:2002Sci...297.1323B. PMID 12193780. doi:10.1126/science.1074580.
- ↑ G. J. Brendel; E. M. Marlett; L. M. Niebylski (1978). «Crystalline beryllium hydride». Inorganic Chemistry (journal) 17 (12): 3589-3592. doi:10.1021/ic50190a051.
- ↑ a b Gordon S. Smith; Quintin C. Johnson; Deane K. Smith; D. E. Cox; Robert L. Snyder; Rong-Sheng Zhou; Allan Zalkin (1988). «The crystal and molecular structure of beryllium hydride». Solid State Communications 67 (5): 491-494. Bibcode:1988SSCom..67..491S. doi:10.1016/0038-1098(84)90168-6.
- ↑ Sujatha Sampath; Kristina M. Lantzky; Chris J. Benmore; Jörg Neuefeind; Joan E. Siewenie (2003). «Structural quantum isotope effects in amorphous beryllium hydride». J. Chem. Phys. 119 (23): 12499. Bibcode:2003JChPh.11912499S. doi:10.1063/1.1626638.
- ↑ a b Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5, p. 1048
- ↑ Sharp, Stephanie B.; Gellene, Gregory I. (23 de noviembre de 2000). «σ Bond Activation by Cooperative Interaction with ns2 Atoms: Be + n H
2, n = 1−3». The Journal of Physical Chemistry A 104 (46): 10951-10957. doi:10.1021/jp002313m. - ↑ Shepherd Jr., Lawrence H.; Ter Haar, G. L.; Marlett, Everett M. (April 1969). «Amine complexes of beryllium hydride». Inorganic Chemistry 8 (4): 976-979. doi:10.1021/ic50074a051.
Enlaces externos
- Esta obra contiene una traducción derivada de «Beryllium hydride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.