Ferrioxalato de potasio
| Ferrioxalato de potasio | ||
|---|---|---|
-2D.png) | ||
_large_crystals.jpg) | ||
| General | ||
| Fórmula estructural | K3[Fe(C2O4)3] | |
| Fórmula molecular | C6FeK3O12 | |
| Identificadores | ||
| Número CAS | 14883-34-2[1] | |
| ChemSpider | 8108406 | |
| PubChem | 24180941 | |
| UNII | BV5XLR9R4O | |
| Propiedades físicas | ||
| Apariencia | Sólido verde | |
| Masa molar | 437,2 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El compuesto es una sal que consiste en aniones ferrioxalato, [Fe(C
2O
4)
3]3−, y cationes potasio K+. El anión es un complejo de oxalato de metal de transición que consiste en la unión en forma de complejo octaédrico de un átomo de hierro en el estado de oxidación +3 con tres ligandos de oxalato bidentados C
2O2−
4. El potasio es un contraión que equilibra la carga -3 del complejo. En disolución, la sal se disocia para dar el anión ferrioxalato, [Fe(C
2O
4)
3]3−, que aparece en color verde fluorescente. La sal está disponible en forma anhidra[2]así como en forma trihidratada.[3]Ambas sustancias son sólidos cristalinos de color verde lima.
El anión ferrioxalato es bastante estable en la oscuridad, pero se descompone cuando se expone a la luz y la radiación electromagnética de alta energía.
Preparación
El complejo se puede sintetizar mediante la reacción entre sulfato de hierro(III), oxalato de bario y oxalato de potasio. Se disuelven en agua y se digieren durante varias horas en un baño de calor. Los iones oxalato del oxalato de bario reemplazarán entonces a los iones sulfato en la disolución, precipitando como BaSO
4 que luego se puede filtrar y cristalizar el ferrioxalato de potasio que queda en solución:[4]
Otra síntesis común es la reacción de una solución acuosa que involucra cloruro de hierro (III) hexahidratado y oxalato monohidratado. Posteriormente, el sólido se filtra mediante un embudo Büchner y se recristaliza para eliminar las impurezas:
Estructura
Las estructuras del trihidrato y de la sal anhidra han sido ampliamente estudiadas.[3] El Fe(III) tiene un espín alto; ya que el complejo de espín bajo mostraría distorsiones de Jahn-Teller. Las sales de amonio y de sodio-potasio mixtas son isomorfas, al igual que los complejos relacionados con Al3+, Cr3+, and V3+ .
El complejo ferrioxalato muestra quiralidad helicoidal ya que puede formar dos geometrías no superponibles. De acuerdo con la convención IUPAC, al isómero con giro en el eje de rotación hacia la izquierda se le asigna el símbolo griego Λ (lambda). Su imagen especular con el giro en el eje de rotación hacia la derecha se representa con el símbolo griego Δ (delta).
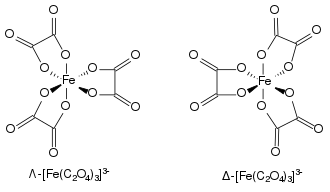
-
![Λ-[Fe(ox)3]3−](./Delta-tris(oxalato)ferrate(III)-3D-balls.png) Λ-[Fe(ox)3]3−
Λ-[Fe(ox)3]3− -
![Δ-[Fe(ox)3]3−](./Lambda-tris(oxalato)ferrate(III)-3D-balls.png) Δ-[Fe(ox)3]3−
Δ-[Fe(ox)3]3−
Reacciones
Fotorreducción
El anión ferrioxalato es sensible a la luz y a la radiación electromagnética de alta energía, incluidos los rayos X y los rayos gamma. Cuando está en solución, el complejo ferrioxalato sufre fotorreducción, un proceso químico en el que se absorben fotones y la sustancia se descompone, en este caso un ion oxalato se descompone en dióxido de carbono (CO
2). El átomo de hierro gana un electrón, pasando al estado de oxidación +2.[5]
Esta propiedad fotosensible se utiliza para la actinometría química, la medida del flujo luminoso y para la preparación de planos. Esta reacción redox catalizada por la luz constituyó en su día la base de algunos procesos fotográficos. Sin embargo, debido a su insensibilidad y a la fácil disponibilidad de fotografía digital avanzada, estos procesos están obsoletos.
Descomposición térmica
El trihidrato pierde las tres moléculas de agua a 113 °C.[6]
A los 296 °C, la sal anhidra se descompone en el complejo de hierro (II), ferrioxalato de potasio, oxalato de potasio y dióxido de carbono:[6]
- 2 K
3[Fe(C
2O
4)
3] → 2 K
2[Fe(C
2O
4)
2] + K
2C
2O
4 + 2 CO
2
Usos
Fotometría y actinometría
El descubrimiento de la fotólisis eficiente del anión ferrioxalato fue un hito para la fotoquímica química y la actinometría. Se descubrió que la sal de potasio era más de 1000 veces más sensible que el oxalato de uranilo, el compuesto utilizado previamente para estos fines.[5][7]
Educación química
La síntesis y descomposición térmica del ferrioxalato de potasio es un ejercicio popular para estudiantes de secundaria, universitarios o preuniversitarios, al involucrar la química de los complejos de metales de transición, la fotoquímica observable visualmente y la termogravimetría.[8]
Cianotipos
Antes de la disponibilidad generalizada de impresoras láser y de inyección de tinta de gran tamaño, los planos y dibujos de ingeniería de gran tamaño se reproducían comúnmente mediante el método de cianotipia.
Se trataba de un proceso fotográfico simple basado en el contacto que producía una copia "negativa" en blanco sobre azul del dibujo original, un plano. El proceso se basaba en la fotólisis de un complejo de hierro (III), que se convierte en una versión insoluble de hierro (II) en las zonas del papel que fueron expuestas a la luz.
El complejo utilizado en cianotipia es principalmente citrato férrico de amonio, pero también se utiliza ferrioxalato de potasio.[9]
Véase también
Se conocen otros oxalatos de hierro:
- Oxalato de hierro (II)
- Oxalato de hierro (III)
- Ferrooxalato de sodio
Referencias
- ↑ Número CAS
- ↑ A. Saritha, B. Raju, M. Ramachary, P. Raghavaiah, and K. A. Hussain (2012) "Synthesis, Crystal Structure and Characterization of Chiral, Three-Dimensional Anhydrous Potassium Tris(oxalato)ferrate(III)", Physica B: Condensed Matter, volume 407, issue 21, pages 4208-4213. doi 10.1016/j.physb.2012.07.005
- ↑ a b Junk, Peter C. (2005). «Supramolecular Interactions in the X-ray Crystal Structure of Potassium Tris(oxalato)ferrate(III) Trihydrate». J. Coord. Chem. 58 (4): 355-361. doi:10.1080/00958970512331334250.
- ↑ Bailar, Jr., John C.; Jones, Eldon M. (1939). «Trioxalato Salts (Trioxalatoaluminiate, -ferriate, -chromiate, and -cobaltiate)». Inorganic Syntheses 1: 35-38. ISBN 9780470132326. doi:10.1002/9780470132326.ch13.
- ↑ a b Hatchard, C. G.; Parker, C. A. (1956). «A new sensitive chemical actinometer. II. Potassium ferrioxalate as a standard chemical actinometer». Proceedings of the Royal Society of London 235 (1203): 518-36. Bibcode:1956RSPSA.235..518H. doi:10.1098/rspa.1956.0102.
- ↑ a b J. Ladriere (1992): "Mössbauer Study on the Thermal Decomposition of Potassium Tris(oxalato)ferrate(III) Trihydrate and Bis(oxalato) ferrate(II) Dihydrate". Hyperfine Interactions, volume 70, issue 1, pages 1095–1098. doi 10.1007/BF02397520
- ↑ Pozdnyakov, Ivan P.; Kel, Oksana V.; Plyusnin, Victor F.; Grivin, Vyacheslav P.; Bazhin, Nikolai M. (2008). «New Insight into Photochemistry of Ferrioxalate». J. Phys. Chem. A 112 (36): 8316-8322. Bibcode:2008JPCA..112.8316P. PMID 18707071. doi:10.1021/jp8040583.
- ↑ John Olmsted (1984): "Preparation and analysis of potassium tris(oxalato)ferrate(III)trihydrate: A general chemistry experiment". Journal of Chemical Education, volume 61, issue 12, page 1098. doi 10.1021/ed061p1098
- ↑ Pablo Alejandro Fiorito and André Sarto Polo (2015): "A New Approach toward Cyanotype Photography Using Tris-(oxalato)ferrate(III): An Integrated Experiment". Journal of Chemical Education, volume 92, issue 10, pages 1721–1724. doi 10.1021/ed500809n