Espectrina
| Familia Espectrina | ||
|---|---|---|
| Identificadores | ||
| Nomenclatura |
Otros nombres Spectrin alpha chain, Erythroid alpha-spectrin
Spectrin beta chain, erythrocytic, | |
| Símbolo | SPTA1 (HGNC: 11272) | |
| Identificadores externos | ||
| Estructura/Función proteica | ||
| Tamaño |
alfa humana: 2.419 a 2.472 aa beta humana: 2.137 a 2.364 (aminoácidos) | |
| Peso molecular |
alfa: 280.000-284.000 (Da) beta: 246.000-416.000 (Da) | |
| Tipo de proteína | Fibrlar | |
| Dominio proteico |
| |
| Motivos | Hélice-bucle-hélice (EF-hand) | |
Las espectrinas[1] son una familia de proteínas fibrilares estructurales, que se encuentr an en todas las células de los metazoarios. Está conformada por cadenas de sub-unidades alfa α y beta β. Su principal función es el mantenimiento de la integridad de la membrana plasmática y la estructura del citoesqueleto, la mediación de la transducción de señales, y plataforma para canales de membrana, receptores y transportadores.[2] Las mutaciones en algunas espectrinas causan anemia hemolítica y otras causan encefalopatía epiléptica.
Historia
En 1968 Marchesi y Steers describieron por primera vez una espectrina en los glóbulos rojos. Algunas formas de espectrina presentes en neuronas, no se identificaron hasta décadas después.
Su nombre deriva de las palabras francesa y latina para fantasma y aparición (spectre y spectrum), ya que se aisló originalmente de las membranas plasmáticas de los fantasmas de eritrocitos.[3]
Se identificaron como proteínas del citoesqueleto que confieren elasticidad a los eritrocitos, permitiéndoles soportar las fuerzas de cizallamiento experimentadas en el sistema circulatorio.[4]
- Si introducimos glóbulos rojos en un medio hipotónico éstos absorben agua y estallan (lisis). Al lisarse, la hemoglobina sale al exterior del glóbulo rojo, quedando la membrana. Después de un tratamiento con un detergente suave para liberar la hemoglobina y otros componentes citoplasmáticos persiste el "fantasma de eritrocitos" (spectre). Una de las proteínas del fantasma es la espectrina, y de ahí le viene el nombre.[5]
Características
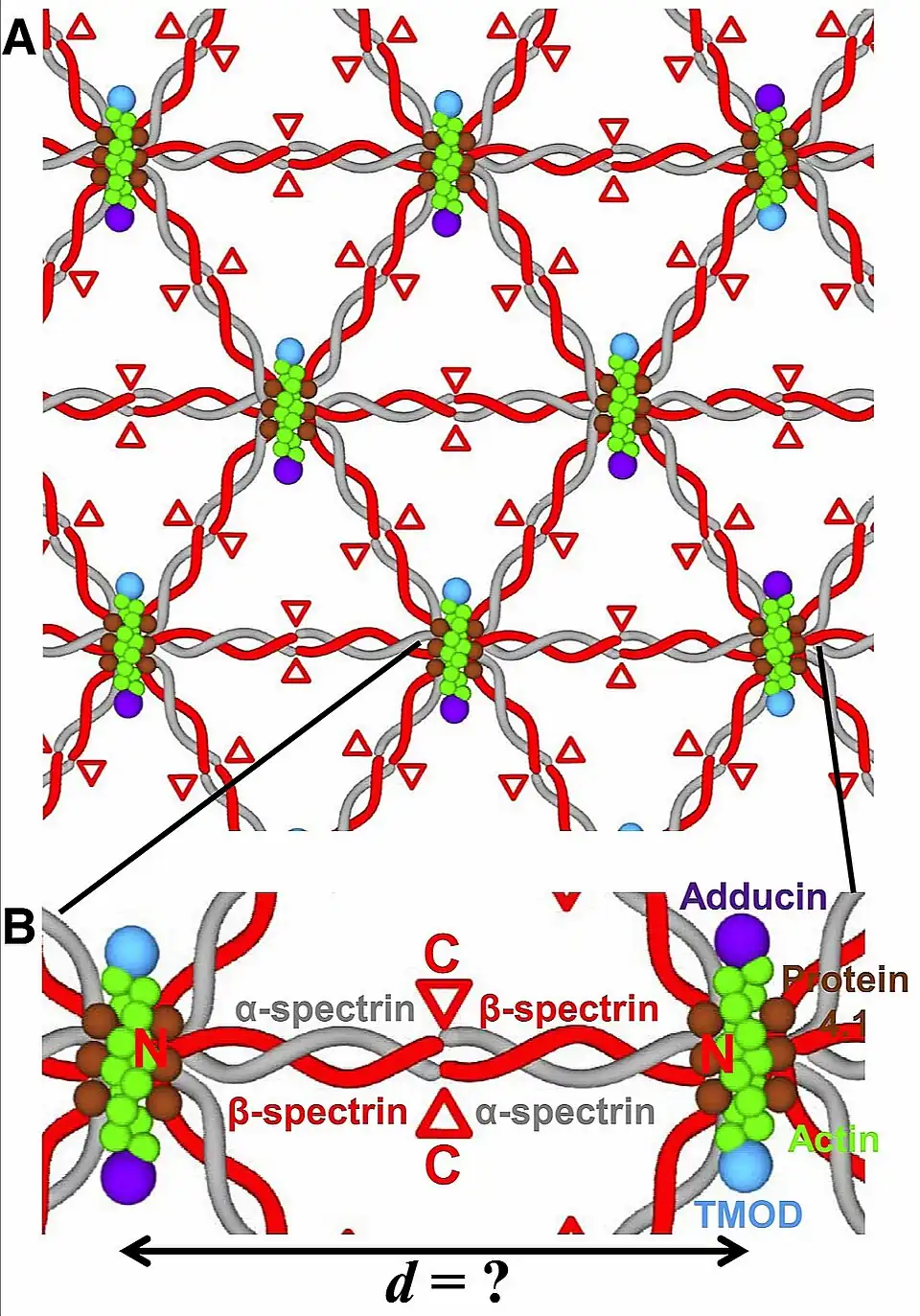
La espectrina es una proteína periférica de membrana fibrilar, por lo que su unión con la membrana plasmática será relativamente débil.[2]
Los vertebrados tienen dos subunidades alfa (α): la espectrina αI y la espectrina αII, y cinco subunidades beta (β).[3]
La espectrina se encuentra en la cara citoplasmática de la membrana y supone el 25% de las proteínas periféricas del eritrocito. Cada hematíe contiene unas 250 mil copias de espectrina.[6][7]
El dominio proteico característico de espectrina, es un extenso subdominio central con numerosas repeticiones superpuestas (spectrin repeat o SR) de 106 a 122 aminoácidos compuesto por tres hélices alfa.[5][8][9]
Espectrinas alfa
La espectrina αI se expresa en los eritrocitos. En otras células, incluidas las neuronas, la espectrina αII es la única subunidad alfa α.
Espectrinas beta
Las diferentes espectrinas β se encuentran en todas las células, pero suelen estar restringidas en diferentes dominios subcelulares, y algunas subunidades β son más abundantes en tipos celulares específicos.
La espectrina βI se concentra en las capas 2 y 4 de la corteza cerebral, las células granulares del cerebelo y en el soma de las células de Purkinje.
La βII se expresa en neuronas y glía.
La βIII se encuentra en el soma y las dendritas de la capa molecular cerebelosa.
La βIV se concentra en los segmentos iniciales del axón y los nódulos de Ranvier.
La espectrina βV se expresa principalmente en la célula pilosa y el fotorreceptor.[4]
| R. | Aminoácidos | Peso molecular |
|---|---|---|
| Alfa I____ αI | 2.419 aminoácidos | 280.014 Daltons |
| Alfa II___ αII | 2.472 aa | 284.539 Da [10] |
| Beta I____ βI | 2.137 aa | 246.468 Da |
| Beta II___ βII | 2.390 aa | 271.325 Da |
| Beta III__ βIII | aa | Da |
| Beta IV__ βIV | aa | Da |
| Beta V___ βV | 3.674 aa | 416.750 Da |
Estructura
La espectrina se encuentra en dímero formando una doble cadena, en la que la cadena alfa α es ligeramente más pesada y grande que la cadena beta β (heterodímero). Dos heterodímeros se asocian para formar un tetrámero.
- Primara
-
- Cadena alfa: 2.419 a 2.472 aminoácidos, peso molecular ~280 014 Daltons (Da).[11]
- Cadena beta: 2.137 a 3.674 aminoácidos, peso molecular 246.468 a 416.750 Da.[12]
- Secundaria
- Dominios de la cadena alfa[11]
- SH3 (Src Homology 3)
- EF-hand 1, 2, 34
- Dominios de la cadena beta[12]
- Calponin-homology (CH)1, 2
- Terciaria
α-spectrin= espectrina alfa en gris.
N= extremo amino beta. C= extremo carboxilo beta.
El elemento estructural central de las espectrinas es una unidad helicoidal repetitiva, denominada repetición de espectrina (SR). Normalmente, se pueden encontrar 20 repeticiones completas en la α-espectrina, mientras que las β-espectrinas contienen 16 (o 29 en el caso de las isoformas β-pesadas).[7]
La espectrina α y la espectrina β interactúan de extremo a extremo para formar un heterodímero. Dos heterodímeros se asocian de manera antiparalela (α-β β-α) para formar un tetrámero, de la interacción del extremo amino (N) de la subunidad α, con el extremo carboxilo (C) de la subunidad β. El tetrámero de la espectrina es la unidad funcional en el citoesqueleto.
Las subunidades de espectrina se componen principalmente de repeticiones de espectrina alfa y beta, que forman una triple hélice superenrollada.[3]
Genética
Los invertebrados poseen un repertorio reducido de genes de espectrina. Los genomas de Caenorhabditis elegans y Drosophila melanogaster incluyen un único gen que codifica una espectrina-α y dos genes que codifican la espectrina-β convencional y una β-pesada.
En el genoma de los mamíferos están presentes cuatro genes β convencionales, SPTB, SPTBN1, SPTBN2, SPTBN4, que codifican las espectrinas βI–βIV y un gen SPTBN5 codifica una gran espectrina βV (β-pesada).[7]
En el humano, los genes son:
- para la cadena Alfa: SPTA1, SPTAN1[13][14]
- para la cadena Beta: SPTB, SPTBN1, SPTBN2, SPTBN4, SPTBN5
Unión a la membrana
Puede hacerlo mediante:
- Unión a la anquirina, la cual será un puente de unión entre la espectrina y una proteína transmembrana llamada banda 3.
- Unión con la actina y la banda 4.1, las cuales servirán para unirse a dos proteínas transmembrana (banda 3 y glucoforina).
Función
La espectrina regula diversos procesos celulares, como la apoptosis, la adhesión celular, la proliferación celular y el ciclo celular.[15]
Las subunidades de espectrina se componen principalmente de repeticiones de espectrina, que forman una superenrollado de triple hélice, que funciona como un resorte para permitir que los tetrámeros de espectrina se expandan y contraigan.[3]
La función que tiene la espectrina es la de dar la forma de disco bicóncavo al eritrocito, constituyendo su citoesqueleto. Debido a su forma, el eritrocito es muy elástico y puede adaptarse para pasar por capilares incluso de diámetros inferiores a él.
El citoesqueleto basado en espectrina es esencial para proteger a los axones de la tensiones mecánicas como son la flexión, el estiramiento y la torsión.[4]
Funciona como interfaz para la mediación de la transducción de señales y diversos datos sobre la interacción de la espectrina con canales de membrana, moléculas de adhesión , receptores y transportadores.[7]
Patología por espectrinas
Si la espectrina es defectuosa se producen alteraciones generales; la severidad dependerá del grado de defecto.[16][15]
Las mutaciones en la espectrina αI o βI causan anemia hemolítica grave debido a la Las mutaciones en la espectrina αI o βI causan anemia hemolítica grave debido a la debilidad y fragilidad de las membranas de los glóbulos rojos.
debilidad y fragilidad de las membranas de los glóbulos rojos.
Las mutaciones de espectrina αII causan encefalopatía epiléptica y Encefalopatía epiléptica y del desarrollo tipo 5, caracterizada por retraso mental profundo, paraplejía espástica y epilepsia.[3]
La pérdida de espectrina-β en las neuronas, provoca un crecimiento axonal anormal. En los músculos, la pérdida de espectrina-β provoca la desorganización de la red de miofilamentos.[17]
Véase también
- Aducinas
Referencias
- ↑ OMS,OPS,BIREME (ed.). «Espectrina». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud.
- ↑ a b Bruce Alberts (2017). «16:The Cytoskeleton». Molecular Biology of the Cell (en inglés) (6.a edición). Garland Science. p. 889.
- ↑ a b c d e Teliska, Lindsay H.; Rasband, Matthew N. (2021). «Spectrins.». Current Biology (en inglés) 31 (10): R504-R506. PMID 34033780. doi:10.1016/j.cub.2021.01.040. Consultado el 19 de agosto de 2025.

- ↑ a b c Liu, Cheng-Hsin; Rasband, Matthew Neil (2019 May 28). «Axonal Spectrins: Nanoscale Organization, Functional Domains and Spectrinopathies». Front Cell Neurosci. (REVISIÓN) (en inglés) (Frontiers (editorial)) 13 (234). doi:10.3389/fncel.2019.00234. Consultado el 20 de agosto de 2025.

- ↑ a b Liem, Ronald KH. (2016). «Cytoskeletal Integrators: The Spectrin Superfamily». Cold Spring Harb Perspect Biol. (REVISIÓN) (en inglés) 8 (10): a018259. doi:10.1101/cshperspect.a018259. Consultado el 26 de agosto de 2025.

- ↑ Pan, Leiting; Yan, Rui; Li, Wan; Xu, Ke (30 January 2018). «Super-Resolution Microscopy Reveals the Native Ultrastructure of the Erythrocyte Cytoskeleton». Cell Reports (en inglés) 22 (5): 1151-1158. Consultado el 19 de agosto de 2025.

- ↑ a b c d Machnicka, Beata; Czogalla, Aleksander; Hryniewicz-Jankowska, Anita; Bogusławska, Dżamila M.; Grochowalska, Renata; Heger, Elżbieta; Sikorski, Aleksander F. (2014). «Spectrins: A structural platform for stabilization and activation of membrane channels, receptors an transporters». Biochimica et Biophysica Acta (BBA) - Biomembranes (REVISIÓN) (en inglés) 1838 (2): 620-634. Consultado el 20 de agosto de 2025.

- ↑ Nicolas, Aurélie ; Delalande, Olivier ; Hubert, Jean-François ; Le Rumeur, Elisabeth (2014). «The spectrin family of proteins: A unique coiled-coil fold for various molecular surface properties». Journal of Structural Biology (en inglés) 186 (3): 392-401. Consultado el 26 de agosto de 2025.

- ↑ Rosenfeld, Jill A. et all. (2021). «Heterozygous variants in SPTBN1 cause intellectual disability and autism». Am J Med Genet A. (en inglés) 185 (7): 2037-2045. doi:10.1002/ajmg.a.62201. Consultado el 26 de agosto de 2025.

- ↑ «Q13813 · SPTN1_HUMAN». UniProt.
- ↑ a b «P02549 · SPTA1_HUMAN». UniProt (en inglés).
- ↑ a b «P11277 · SPTB1_HUMAN». UniProt (en inglés).
- ↑ «SPTAN1». HGNC (en inglés).
- ↑ «Gene and protein summary for SPTA1». EBI (en inglés).
- ↑ a b Li, Shan; Liu, Ting; Li, Kejing; Bai, Xinyi; Xi, Kewang; Chai, Xiaojing; Mi, Leyuan (2022 May). «Spectrins and human diseases». Review Transl Res. (en inglés) (78-88). doi:10.1016/j.trsl.2021.12.009.

- ↑ Soler Noda, Gilberto; Peña Leyva, Kirenia; Forrellat Barrios, Mariela (2020). «Anemias hemolíticas hereditarias por defectos en la membrana de los eritrocitos». Rev Cubana Hematol Inmunol Hemoter (REVISIÓN) (la Habana: SciELO) 36 (2). Consultado el 29 de agosto de 2025.

- ↑ Marc Hammarlund; Warren S. Davis; Erik M Jorgensen (2000 May 15). «Mutations in β-Spectrin Disrupt Axon Outgrowth and Sarcomere Structure». J Cell Biol. (en inglés) 149 (4): 931-942. PMC 2174563. PMID 10811832. doi:10.1083/jcb.149.4.931. Consultado el 27 de agosto de 2025.

[http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowTOC&rid=mboc4.TOC&depth=10 Molecular Biology of the Cell, Alberts et.al. 2002]