Doblecortina
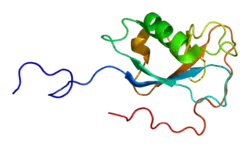
La proteína de migración neuronal doblecortina, también conocida como doblina o lisencefalina-X es una proteína codificada en humanos por el gen DCX.[4] Se encuentra asociada a los microtúbulos y se expresa tanto en estructuras embrionarias como en estructuras corticales adultas.
Función
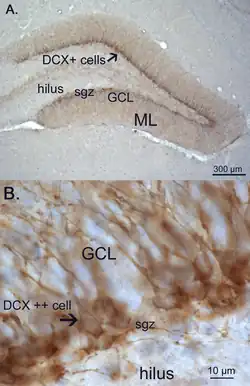
La doblecortina o DCX es una proteína asociada a microtúbulos que se expresa en células precursoras neurales y neuronas inmaduras. Esta proteína se expresa tanto en estructuras embrionarias como en estructuras corticales adultas. Los células precursoras neurales expresan doblecortina mientras se dividen y sus células descendientes continúan expresándola durante 2 o 3 semanas mientras maduran a neuronas. La expresión de DCX disminuye tras dos semanas a medida que las células comienzan a expresar la proteína nuclear neuronal NeuN (Neuronal Nuclei), un marcador característico de neuronas maduras.[6]
Debido a que la DCX se expresa casi exclusivamente en neuronas en desarrollo, es utilizada como marcador de la neurogénesis. La expresión de doblecortina se incrementa además cuando hay mayor neurogénesis, por ejemplo, después del ejercicio físico.[7]
La doblecortina se une a los microtúbulos del citoesqueleto y se ha demostrado mediante estudios in vivo e in vitro que la doblecortina estabiliza los microtúbulos causando su agregación.
La doblecortina es una proteína básica con un punto isoeléctrico de 10, como es común en proteínas de unión a microtúbulos.[8]
Ratones con mutaciones nulas
En ratones donde se anula la expresión de DCX las capas corticales del cerebro se forman correctamente, sin embargo, la capa CA3 del hipocampo se encuentra desorganizada y en lugar de la capa simple de neuronas piramidales se forma una capa doble. Estos ratones muestran un comportamiento alterado y epilepsia.[9]
Estructura
El análisis detallado de la secuencia de la doblecortina y de proteínas similares permitió la identificación de una repetición en tandem de dominios conservados evolutivamente. Estos dominios se encuentran en la porción N-terminal de las proteínas y consisten en repeticiones de una región de unos 80 aminoácidos. Se ha sugerido que el primer dominio de la doblecortina se une a la tubulina ayudando a la polimerización de los microtúbulos.[10]
Interacciones
La doblecortina interacciona con el gen PAFAH1B1.[11] Este gen codifica el factor activador de plaquetas (PAF) acetilhidrolasa IB subunidad alfa también conocido como LIS1.
Significancia clínica
La doblecortina se encuentra mutada en la lisencefalia ligada al cromosoma X y en el síndrome de corteza doble de forma que las manifestaciones clínicas varían según el sexo. En hombres la lisencefalia produce un cerebro liso debido a los fallos en la migración de neuronas inmaduras que normalmente promueven la formación de los giros de la superficie cerebral. En mujeres generalmente se produce el síndrome de la corteza doble que se caracteriza por la migración anormal de tejido neural durante el desarrollo, resultando en dos bandas de neuronas mal colocadas bajo la sustancia blanca subcortical, generando dos cortezas.[12] Esta mutación fue descubierta por Joseph Gleeson y Christopher A. Walsh en Boston.[13][14]
Véase también
Referencias
- ↑ «Diseases that are genetically associated with DCX view/edit references on wikidata».
- ↑ «Human PubMed Reference:».
- ↑ «Mouse PubMed Reference:».
- ↑ EntrezGene 1641
- ↑ Oomen CA, Girardi CE, Cahyadi R, Verbeek EC, Krugers H, Joëls M, Lucassen PJ (2009). «Opposite effects of early maternal deprivation on neurogenesis in male versus female rats». PLoS ONE 4 (1): e3675. PMC 2629844. PMID 19180242. doi:10.1371/journal.pone.0003675.
- ↑ Brown JP, Couillard-Després S, Cooper-Kuhn CM, Winkler J, Aigner L, Kuhn HG (diciembre de 2003). «Transient expression of doublecortin during adult neurogenesis». J. Comp. Neurol. 467 (1): 1-10. PMID 14574675. doi:10.1002/cne.10874.
- ↑ Couillard-Despres S, Winner B, Schaubeck S, Aigner R, Vroemen M, Weidner N, Bogdahn U, Winkler J, Kuhn HG, Aigner L (enero de 2005). «Doublecortin expression levels in adult brain reflect neurogenesis». Eur. J. Neurosci. 21 (1): 1-14. PMID 15654838. doi:10.1111/j.1460-9568.2004.03813.x.
- ↑ Horesh D, Sapir T, Francis F, Wolf SG, Caspi M, Elbaum M, Chelly J, Reiner O (septiembre de 1999). «Doublecortin, a stabilizer of microtubules». Hum. Mol. Genet. 8 (9): 1599-610. PMID 10441322. doi:10.1093/hmg/8.9.1599.
- ↑ Nosten-Bertrand M, Kappeler C, Dinocourt C, Denis C, Germain J, Phan Dinh Tuy F, Verstraeten S, Alvarez C, Métin C, Chelly J, Giros B, Miles R, Depaulis A, Francis F (25 de junio de 2008). «Epilepsy in Dcx knockout mice associated with discrete lamination defects and enhanced excitability in the hippocampus». PloS One 3 (6): e2473. PMC 2429962. PMID 18575605. doi:10.1371/journal.pone.0002473.
- ↑ Sapir T, Horesh D, Caspi M, Atlas R, Burgess HA, Wolf SG, Francis F, Chelly J, Elbaum M, Pietrokovski S, Reiner O (marzo de 2000). «Doublecortin mutations cluster in evolutionarily conserved functional domains». Hum. Mol. Genet. 9 (5): 703-12. PMID 10749977. doi:10.1093/hmg/9.5.703.
- ↑ Caspi M, Atlas R, Kantor A, Sapir T, Reiner O (septiembre de 2000). «Interaction between LIS1 and doublecortin, two lissencephaly gene products». Hum. Mol. Genet. 9 (15): 2205-13. PMID 11001923. doi:10.1093/oxfordjournals.hmg.a018911.
- ↑ OMIM 300121
- ↑ Gleeson JG, Allen KM, Fox JW, Lamperti ED, Berkovic S, Scheffer I, Cooper EC, Dobyns WB, Minnerath SR, Ross ME, Walsh CA (enero de 1998). «Doublecortin, a brain-specific gene mutated in human X-linked lissencephaly and double cortex syndrome, encodes a putative signaling protein». Cell 92 (1): 63-72. PMID 9489700. doi:10.1016/S0092-8674(00)80899-5.
- ↑ Lowenstein DH (2011). «Seizures and Epilepsy». En Loscalzo J, Longo DL, Fauci AS, Kasper DL, Hauser SL, ed. Harrison's Principles of Internal Medicine (18th edición). McGraw-Hill Professional. pp. 3251-3269. ISBN 0-07-174889-X.
Información adicional
- des Portes V, Pinard JM, Smadja D (1997). «Dominant X linked subcortical laminar heterotopia and lissencephaly syndrome (XSCLH/LIS): evidence for the occurrence of mutation in males and mapping of a potential locus in Xq22.». J. Med. Genet. 34 (3): 177-83. PMC 1050888. PMID 9132485. doi:10.1136/jmg.34.3.177.
- des Portes V, Pinard JM, Billuart P (1998). «A novel CNS gene required for neuronal migration and involved in X-linked subcortical laminar heterotopia and lissencephaly syndrome.». Cell 92 (1): 51-61. PMID 9489699. doi:10.1016/S0092-8674(00)80898-3.
- Gleeson JG, Allen KM, Fox JW (1998). «Doublecortin, a brain-specific gene mutated in human X-linked lissencephaly and double cortex syndrome, encodes a putative signaling protein.». Cell 92 (1): 63-72. PMID 9489700. doi:10.1016/S0092-8674(00)80899-5.
- des Portes V, Francis F, Pinard JM (1999). «doublecortin is the major gene causing X-linked subcortical laminar heterotopia (SCLH).». Hum. Mol. Genet. 7 (7): 1063-70. PMID 9618162. doi:10.1093/hmg/7.7.1063.
- Sossey-Alaoui K, Hartung AJ, Guerrini R (1998). «Human doublecortin (DCX) and the homologous gene in mouse encode a putative Ca2+-dependent signaling protein which is mutated in human X-linked neuronal migration defects.». Hum. Mol. Genet. 7 (8): 1327-32. PMID 9668176. doi:10.1093/hmg/7.8.1327.
- Pilz DT, Matsumoto N, Minnerath S (1999). «LIS1 and XLIS (DCX) mutations cause most classical lissencephaly, but different patterns of malformation.». Hum. Mol. Genet. 7 (13): 2029-37. PMID 9817918. doi:10.1093/hmg/7.13.2029.
- Gleeson JG, Minnerath SR, Fox JW (1999). «Characterization of mutations in the gene doublecortin in patients with double cortex syndrome.». Ann. Neurol. 45 (2): 146-53. PMID 9989615. doi:10.1002/1531-8249(199902)45:2<146::AID-ANA3>3.0.CO;2-N.
- Kato M, Kimura T, Lin C (1999). «A novel mutation of the doublecortin gene in Japanese patients with X-linked lissencephaly and subcortical band heterotopia.». Hum. Genet. 104 (4): 341-4. PMID 10369164. doi:10.1007/s004390050963.
- Gleeson JG, Lin PT, Flanagan LA, Walsh CA (1999). «Doublecortin is a microtubule-associated protein and is expressed widely by migrating neurons.». Neuron 23 (2): 257-71. PMID 10399933. doi:10.1016/S0896-6273(00)80778-3.
- Pilz DT, Kuc J, Matsumoto N (2000). «Subcortical band heterotopia in rare affected males can be caused by missense mutations in DCX (XLIS) or LIS1.». Hum. Mol. Genet. 8 (9): 1757-60. PMID 10441340. doi:10.1093/hmg/8.9.1757.
- Sakamoto M, Ono J, Okada S (2000). «Genetic alteration of the DCX gene in Japanese patients with subcortical laminar heterotopia or isolated lissencephaly sequence.». J. Hum. Genet. 45 (3): 167-70. PMID 10807542. doi:10.1007/s100380050204.
- Caspi M, Atlas R, Kantor A (2001). «Interaction between LIS1 and doublecortin, two lissencephaly gene products.». Hum. Mol. Genet. 9 (15): 2205-13. PMID 11001923. doi:10.1093/oxfordjournals.hmg.a018911.
- Matsumoto N, Leventer RJ, Kuc JA (2001). «Mutation analysis of the DCX gene and genotype/phenotype correlation in subcortical band heterotopia.». Eur. J. Hum. Genet. 9 (1): 5-12. PMID 11175293. doi:10.1038/sj.ejhg.5200548.
- Demelas L, Serra G, Conti M (2001). «Incomplete penetrance with normal MRI in a woman with germline mutation of the DCX gene.». Neurology 57 (2): 327-30. PMID 11468322. doi:10.1212/wnl.57.2.327.
- Friocourt G, Chafey P, Billuart P (2001). «Doublecortin interacts with mu subunits of clathrin adaptor complexes in the developing nervous system.». Mol. Cell. Neurosci. 18 (3): 307-19. PMID 11591131. doi:10.1006/mcne.2001.1022.
- Kato M, Kanai M, Soma O (2001). «Mutation of the doublecortin gene in male patients with double cortex syndrome: somatic mosaicism detected by hair root analysis.». Ann. Neurol. 50 (4): 547-51. PMID 11601509. doi:10.1002/ana.1231.
- des Portes V, Abaoub L, Joannard A (2002). «So-called 'cryptogenic' partial seizures resulting from a subtle cortical dysgenesis due to a doublecortin gene mutation.». Seizure : the journal of the British Epilepsy Association 11 (4): 273-7. PMID 12027577. doi:10.1053/seiz.2001.0607.
- Kizhatil K, Wu YX, Sen A, Bennett V (2002). «A new activity of doublecortin in recognition of the phospho-FIGQY tyrosine in the cytoplasmic domain of neurofascin.». J. Neurosci. 22 (18): 7948-58. PMID 12223548.
- D'Agostino MD, Bernasconi A, Das S (2002). «Subcortical band heterotopia (SBH) in males: clinical, imaging and genetic findings in comparison with females.». Brain 125 (Pt 11): 2507-22. PMID 12390976. doi:10.1093/brain/awf248.
- Meyer G, Perez-Garcia CG, Gleeson JG (2003). «Selective expression of doublecortin and LIS1 in developing human cortex suggests unique modes of neuronal movement.». Cereb. Cortex 12 (12): 1225-36. PMID 12427674. doi:10.1093/cercor/12.12.1225.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre doblecortina.
Wikimedia Commons alberga una categoría multimedia sobre doblecortina.- Enfermedades relacionadas con DCX en GeneReviews/NCBI/NIH/UW
- Enfermedades relacionadas con DCX en OMIM
- MeSH: doublecortin+protein (en inglés) Búsqueda en Mesh