Cloruro de bencenosulfonilo
| Cloruro de bencenosulfonilo | ||
|---|---|---|
 | ||
| General | ||
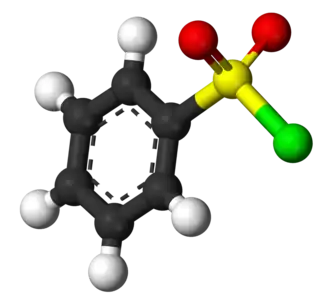
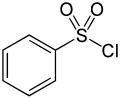
| Fórmula estructural |
 | |
| Fórmula molecular |
C 6H 5SO 2Cl | |
| Identificadores | ||
| Número CAS | 98-09-9[1] | |
| ChEMBL | CHEMBL1479161 | |
| ChemSpider | 7091 | |
| PubChem | 7369 | |
| UNII | OI9V0QJV9N | |
|
C1=CC=C(C=C1)S(=O)(=O)Cl
| ||
| Propiedades físicas | ||
| Densidad | 1384 kg/m³; 1,384 g/cm³ | |
| Masa molar | 176,62 g/mol | |
| Punto de fusión | 13 °C (286 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de bencenosulfonilo es un compuesto organosulfurado con la fórmula C6H5SO2Cl. Es un líquido viscoso, de aspecto aceitoso, incoloro y soluble en disolventes orgánicos. Reacciona con compuestos que contienen enlaces reactivos amino, -NH; es decir con aminas primarias y secundarias, para dar sulfonamidas. La reacción es diferente según que la amina sea primaria o secundaria, lo que constituye la base del ensayo de Hinsberg para la diferenciación de las aminas. [2] También reacciona, en medio básico, con compuestos orgánicos que contienen el grupo hidroxilo, -OH (alcoholes y fenoles), para dar los correspondientes ésteres sulfónicos.[3] Esta reactividad del cloruro de bencenosulfonilo hace que se utilice principalmente en la síntesis de sulfonamidas y ésteres de sulfonato a partir de aminas y alcoholes, respectivamente. El compuesto está estrechamente relacionado con el cloruro de toluenosulfonilo, que es el que se utiliza a menudo, porque es un sólido a temperatura ambiente y más fácil de manipular.
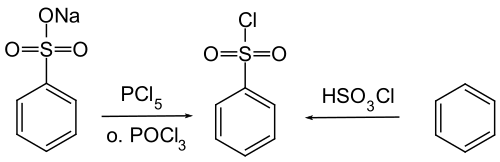
El compuesto se prepara mediante la cloración del ácido bencenosulfónico o sus sales con oxicloruro de fósforo [4] o, con menor frecuencia, mediante una reacción entre benceno y ácido clorosulfúrico .
La prueba de Hinsberg para aminas implica su reacción con cloruro de bencenosulfonilo. [5]
Referencias
- ↑ Número CAS
- ↑ Allinger, Norman L. y otros (1973). «Cap. 21. Reacciones de los compuestos orgánicos del nitrógeno.». Química orgánica. Barcelona: Reverté. pp. 809-810.
- ↑ Allinger, Norman L. y otros (1975). «Cap. 18.5. Conversión de alcoholes en ésteres». Química Orgánica. Reverté. pp. 631-632.
- ↑ Roger Adams, C. S. Marvel, H. T. Clarke, G. S. Babcock, and T. F. Murray "Benzenesulfonyl chloride" Org. Synth. 1921, vol. 1, p. 21. doi 10.15227/orgsyn.001.0021
- ↑ Ralph L. Shriner, Christine K. F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson "The Systematic Identification of Organic Compounds", 8th Edition, 2003, Wiley. ISBN 978-0-471-21503-5