Ciclo ozono-oxígeno
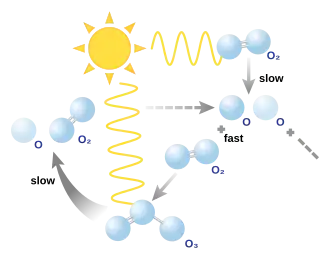
El ciclo ozono-oxígeno es un proceso de formación, recombinación y descomposición del ozono que se produce de forma continua en la estratosfera de la Tierra, permitiendo que la concentración de ozono en la ozonosfera se mantenga relativamente constante, sin grandes variaciones. Se trata de un proceso fotoquímico en el que interviene la radiación ultravioleta (UV) procedente del sol. Este proceso cíclico también recibe el nombre de ciclo Chapman, en honor a Sydney Chapman que en 1930 resolvió el problema químico involucrado.[1]
La mayor parte del ozono se produce en la estratosfera superior y la mesosfera tropicales. La masa total de ozono producida diariamente en el planeta es de aproximadamente 400 millones de toneladas métricas. La masa global de ozono se mantiene relativamente constante en unas 3 mil millones de toneladas métricas, lo que significa que el Sol produce aproximadamente el 12% de la capa de ozono cada día. [2]
Secuencia cíclica de Chapman
El ciclo Chapman describe las principales reacciones que hacen que, de forma natural y en primera aproximación, la concentración de ozono en la estratosfera se mantenga, hasta cierto punto constante. Incluye una serie de etapas en las que intervienen las principales formas alotrópicas del oxígeno y la radiación UV.[3]
Creación
Una molécula de oxígeno es disociado por la luz ultravioleta de frecuencia más alta (extremo superior de UV-B, UV-C y superiores) produciendo dos átomos de oxígeno (fotodisociación del oxígeno molecular).
El oxígeno atómico es extremadamente reactivo, por lo que casi inmediatamente cada átomo de oxígeno reacciona con una molécula de oxígeno para formar una molécula de ozono (creación del ozono):
donde M representa una molécula o átomo adicional presente en el medio ("tercer cuerpo"), generalmente N2 o O2 que son las especies más abundantes en la estratosfera. La intervención de este "tercer cuerpo" es necesaria para mantener la conservación de la energía y el momento en la reacción.
Descomposición
El ozono es una molécula muy inestable que se descompone fotoquímicamente. Las moléculas de ozono formadas por la reacción anterior, absorben radiación electromagnética con longitudes de onda características de la radiación UV-C y UV-B (fotodisociación del ozono).
El oxígeno atómico producido puede volver a reaccionar con otra molécula de oxígeno para reformar el ozono a través de la reacción de creación de ozono, o puede reaccionar con otra molécula de ozono para producir dos moléculas de oxígeno (renovación del oxígeno).
De estas cuatro reacciones, la primera y la última se producen a mucha menor velocidad que las otras dos. Esto hace que los niveles de ozono en la estratosfera se mantengan relativamente constantes. También es posible una quinta reacción, pero esta tiene mucha menor importancia ya que en la estratosfera la concentración de átomos de oxígeno es extremadamente baja, mucho menor que la de moléculas de oxígeno diatómico.
Procesos catalíticos de eliminación del ozono
A pesar de que el ciclo de Chapman describe correctamente la forma que tiene la capa de ozono, así como la altitud a la que se produce la máxima concentración de este alótropo del oxígeno, falla en la predicción de la concentración absoluta del ozono, que de acuerdo con la termodinámica de las reacciones del ciclo de Chapman, debería ser mayor que las obtenidas por las mediciones realizadas en su momento, lo que implica que tienen que existir otras reacciones que favorezcan la descomposición del ozono. Existen ciertos radicales libres, como el radical hidroxilo (•OH), el monóxido de nitrógeno (NO) o el cloro (Cl) y el bromo (Br) atómicos que catalizan la reacción de recombinación del oxígeno atómico en oxígeno molecular, lo que da lugar a una capa de ozono más delgada de lo que sería de esperar si solo se considerasen las reacciones del ciclo de Chapman, sin la intervención de los catalizadores.[4]
El proceso catalítico consta de dos reacciones concatenadas:[5][6]
donde X representa la especie (radical libre, molécula o átomo) que actúa como catalizador. El proceso neto resultante es:
La mayor parte del •OH y el NO se encuentran de forma natural en la estratosfera, pero la actividad humana y en especial las emisiones de clorofluorocarbonos (CFC) y halones, ha incrementado considerablemente la concentración de Cl y Br, lo que ha provocado un mayor adelgazamiento de la capa de ozono e incluso la destrucción del ozono en zonas de la estratosfera situadas sobre el Polo Sur, dando lugar al fenómeno conocido como agujero de ozono. Cada átomo de Cl o Br puede catalizar decenas de miles de reacciones de descomposición antes de ser eliminado de la estratosfera.
Dependiendo de la altitud y de la posibilidad de mezcla, cada especie catalizadora puede ser más o menos determinante en la descomposición del ozono. Por ejemplo, a altitudes próximas a los 50 km son los radicales hidroxilados (•OH y •OOH) los principales intervinientes, estimándose que contribuyen en un 70% a los mecanismos de descomposición del ozono en estas altitudes. En la zona intermedia, hacia los 25-30 km de altitud, donde la concentración de ozono es mayor, los mecanismos de descomposición catalítica está encabezados por los óxidos de nitrógeno (NO y N2O) y sus radicales.[6] Estos radicales, junto con los provenientes de los halógenos (Cl o Br), son lo que afectan más al ozono que se encuentra por debajo de los 30 km de altitud.
Véase también
Referencias
- ↑ Chapman, S. A. (1930). «A Theory of Upper-atmospheric Ozone». Memoirs of the Royal Meteorological Society 3 (26): 103-125. Consultado el 20 de marzo de 2025.
- ↑ «Chapter 5: Stratospheric Photochemistry». Stratospheric Ozone: An Electronic Textbook. Archivado desde el original el 27 de julio de 2011. Consultado el 16 de junio de 2011.
- ↑ VanLoon, Gary W.; Duffy, Stephen J. (2005). «Chap. 3.2. Oxigen-only chemistry-formation and turnover of ozone. The Chapman reaction sequence». Environmental chemistry: a global perspective (en inglés) (2nd ed edición). Oxford University Press. ISBN 978-0-19-927499-4. OCLC ocm60130425. Consultado el 21 de abril de 2024.
- ↑ Manahan, Stanley E. (2007). «Cap. 8.10. reacciones del oxígeno atmosférico». Introducción a la química ambiental (Reimpresión de la primera edición). Barcelona: Reverté Eds. [u.a.] ISBN 978-84-291-7907-1.
- ↑ Doménech, Xavier (1991). «Cap. 3.1. Reacciones catalíticas de eliminación del ozono». Química Atmosférica. Origen y efectos de la contaminación. Miraguano. ISBN 84-7813-079-9.
- ↑ a b VanLoon, Gary W.; Duffy, Stephen J. (2005). «Chap. 3.3 Processes for catalytic decomposition of ozone». Environmental chemistry: a global perspective (en inglés) (2nd ed edición). Oxford University Press. ISBN 978-0-19-927499-4. OCLC ocm60130425. Consultado el 21 de abril de 2024.